2025年9月25日,国科大杭州高等研究院张夏衡实验室与俞飚院士团队合作,在Chem期刊上发表了题为“Rewriting lysine reactivity: Lysine-targeted bioconjugation via biomimetic polarity reversal for diversified biomolecule modification”的研究论文。该研究报道了一种新型仿生氧化脱氨策略,实现了多肽和蛋白质上赖氨酸残基的位点选择性修饰。传统赖氨酸的修饰依赖于赖氨酸残基的亲核性,受其余天然氨基酸残基(如半胱氨酸、组氨酸等)亲核性的影响,之前报道的赖氨酸的修饰方法具有较多的限制。上述研究团队巧妙运用仿生策略,成功实现赖氨酸残基在原位形成具有亲电特性的醛中间体。该中间体能够精准且选择性地与多种携带不同官能团的亲核试剂发生反应进而实现定点赖氨酸修饰。该策略具有优异的生物兼容性和化学选择性,有效突破了传统赖氨酸修饰方法所面临的局限性。
该项目主要由汪露特聘副研究员和硕士研究生杨鸿向完成。张夏衡研究员和陈小平副研究员为论文通讯作者,俞飚院士在本研究中提供了关键指导与支持。
天然蛋白质中的翻译后修饰(PTM)显著拓展了蛋白质结构与功能的多样性。迄今为止,仅有限数量的官能团能通过天然PTM直接引入到蛋白质中。进而,仿生策略已被广泛应用于蛋白质修饰领域以模拟这些PTM过程,旨在增强蛋白质的功能多样性,以拓展其应用范围(图1A)。赖氨酸残基在蛋白质中含量丰富且在生理过程中起关键作用,传统赖氨酸修饰方法主要依赖其侧链氨基的亲核性,通过与各种亲电试剂(如醛类、活性酯及迈克尔受体等)反应来实现赖氨酸的修饰。该类方法常常会发生脱靶反应且官能团兼容性差,修饰过程中易与丝氨酸、酪氨酸、半胱氨酸等其他亲核残基发生非特异性反应,严重限制了其在生物医学领域的应用(图1B)。因此,开发一种具有高度特异性的赖氨酸修饰策略,已然成为该领域亟待解决的关键难题。
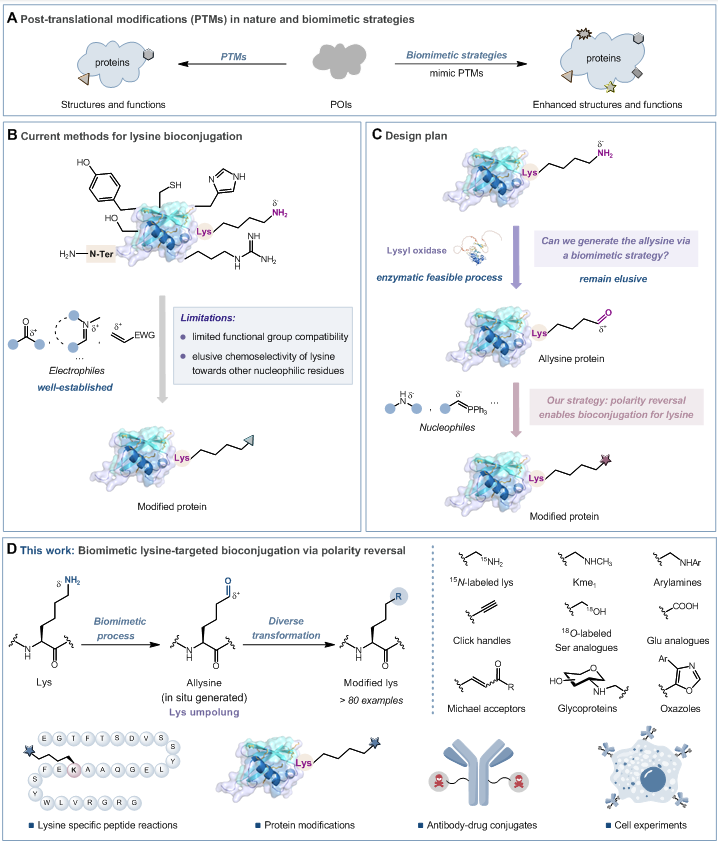
图1:生物分子中赖氨酸生物偶联的发展。
针对这一挑战,张夏衡研究员和俞飚院士团队开发出一种仿生极性反转策略,有效改变了赖氨酸残基固有的反应性(图1C)。他们以廉价易得的邻醌作为氧化剂,在生理相容的条件下,高选择性地将赖氨酸侧链的亲核ε-氨基氧化成亲电醛基中间体,从根本上解决了传统方法面临的选择性困境(图1D)。基于此关键技术,团队运用两步一锅法针对醛赖氨酸开展了多样性转化研究,在生理相容条件下高效实现了一系列经典有机反应,如还原胺化反应、Wittig反应、Seyferth-Gilbert反应、Pinnick氧化反应以及Van Leusen反应等(图2)。
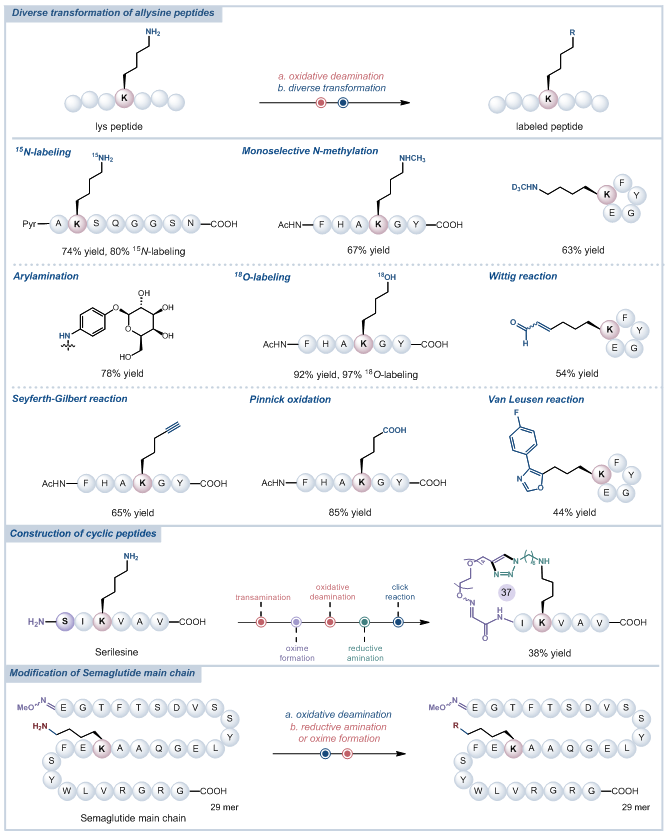
图2:赖氨酸的多样性转化。
为验证该策略的普适性,该团队还在商业可得的药物肽上成功构建了一系列新颖的环肽结构,并在临床明星药物索玛鲁肽(GLP-1受体激动剂)骨架中成功引入多种功能分子模块,有望提高其潜在的应用价值(图2)。此外,该团队还将这一修饰策略拓展至蛋白质与抗体等生物大分子领域:从泛素、溶菌酶等小分子蛋白,到分子量约150 kDa的抗体(如曲妥珠单抗),均实现了高效、高选择性的赖氨酸修饰(图3)。实验结果表明,修饰后的生物大分子仍能保持稳定的二级结构与生物活性,充分表明该策略在复杂生物体系中的适用性与高效性,为蛋白质工程、抗体药物偶联物(ADCs)研发等领域提供了全新技术工具。
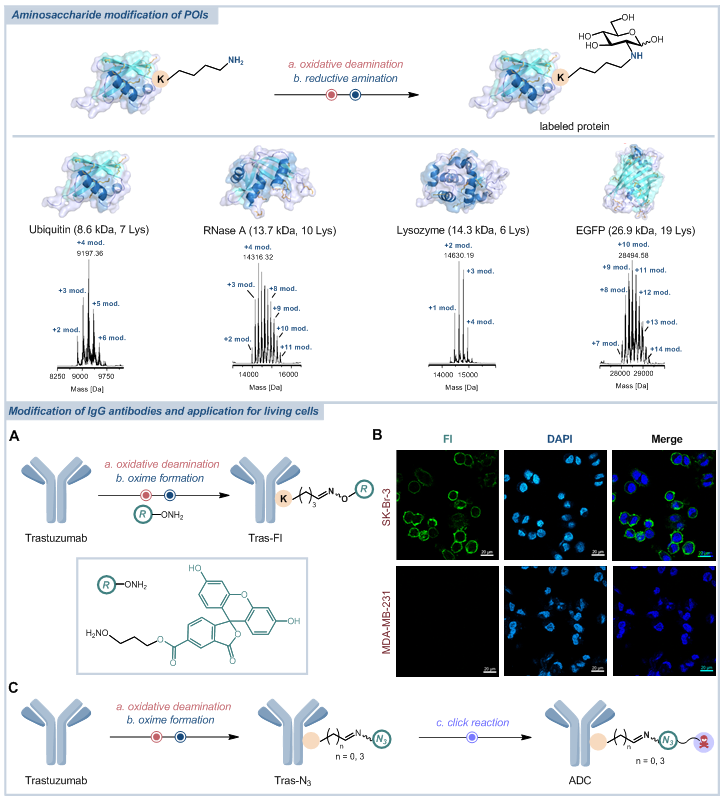
图3:蛋白和抗体的修饰及活细胞实验。
综上所述,该策略克服了传统赖氨酸化学修饰方法的局限性,创新性地为赖氨酸特异性化学修饰开拓出全新的路径,有望成为推动多肽和蛋白质修饰领域发展的新型技术手段。(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.chempr.2025.102744