|
|
|
|
|
暨南大学辛洪宝等人ACS Nano | 基于反向等离激元共振能量转移的单细胞器水平酶分子活动长期监测 |
|
|

本期分享一篇2025年发表在ACS Nano上的研究,题为《Long-Term Monitoring of Enzymatic Activity at the Single-Organelle Level via Reversed Plasmonic Resonance Energy Transfer》。论文通讯作者为暨南大学物理与光电工程学院的李宝军教授、哈佛大学医学院的Luke P. Lee教授以及暨南大学的李宝军和辛洪宝教授。
— 引言 —
细胞器间的相互作用在细胞代谢、信号转导和应激响应等生命过程中至关重要,而酶活动变化是其核心调控因素。内体-溶酶体通路作为重要的细胞物质运输与信号调控系统,其涉及到的酶分子活动异常与神经退行性疾病、代谢紊乱和癌症密切相关。然而,现有荧光标记技术难以长期、精准地追踪细胞器水平的酶分子动态。
为此,本研究创新性地构建了反向等离激元共振能量转移(rPRET)纳米天线,通过海胆状金纳米颗粒(uGNP)与黑洞猝灭分子(BHQ-3)的能量抑制与恢复设计,实现了对内体-溶酶体途径中酶分子活动的单细胞器水平长期动态监测。该技术在突破传统荧光探针局限的同时,为揭示细胞代谢调控与疾病机制提供了全新的研究手段。
— 创新点 —
本研究发展出反向等离激元共振能量转移rPRET实现酶分子活动动态监测的新方法,实现了单细胞器互作过程中酶分子活动的长期实时监测,将酶分子活动的长时间实时监测推进至单细胞器水平,揭示了癌细胞与非癌细胞细胞器内酶分子活动的差异,并发现氧浓度可调控内体–溶酶体融合动力学。
— 主要工作 —
rPRET纳米天线的工作原理与性能优化
本研究构建了可经内吞作用进入活细胞的 rPRET 纳米天线,实现了内体–溶酶体通路中偶氮还原酶(AzoR)活动的长期动态监测。AzoR特异性切割纳米天线中BHQ-3分子的偶氮双键,触发能量恢复,从而以散射光谱变化实时反映酶分子活动。该系统实现了单细胞器水平的酶分子活动可视化,并通过结构与信号处理优化显著提升检测灵敏度和信噪比。相比传统荧光探针,rPRET 纳米天线具有无光漂白、高稳定性和长时监测优势,为从单细胞器层面研究细胞代谢与病理过程提供了新手段。
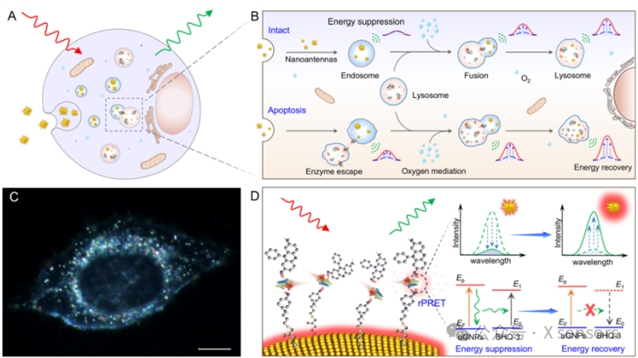
图1. rPRET纳米天线在单细胞器水平监测酶分子活动的工作原理。(A) rPRET纳米天线通过内吞作用内化到活细胞中以监测内体-溶酶体途径中酶活动的示意图。(B) rPRET纳米天线在内体-溶酶体途径中监测氧介导的酶活动纳米光谱示意图。(C) 单个活细胞内吞具有不同共振峰的等离激元纳米天线暗场图。比例尺:10 μm。(D) rPRET纳米天线检测原理和能量转移过程的示意图。
单个溶酶体酶分子活动监测
基于rPRET纳米天线的优异性能,本研究实现了单个溶酶体水平的酶分子活动精准检测。溶酶体是细胞内重要的降解与代谢调控中心,富含多种水解酶,其中AzoR在细胞代谢与疾病过程中具有关键作用。研究通过提取完整溶酶体并与rPRET天线作用,利用局部光热效应促使膜破裂,实现AzoR与纳米天线的高效反应,从而获得稳定可重复的检测信号。研究结果表明,癌细胞中溶酶体AzoR活性显著高于非癌细胞,揭示了癌细胞特有的酶活性增强特征。该方法在单细胞器分辨率下实现高灵敏酶分子活动检测,为从单细胞器层面解析肿瘤代谢异常及细胞器功能失调提供了新思路,并为早期疾病诊断和药物筛选提供了技术基础。
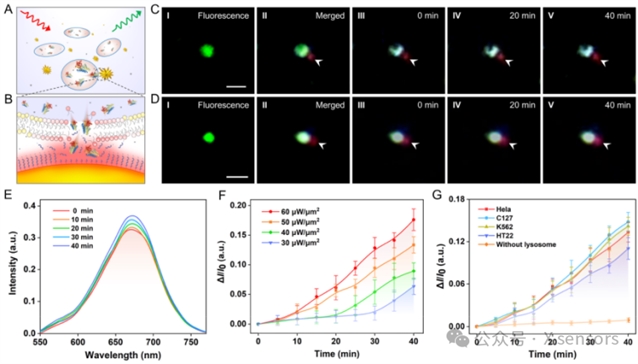
图2. rPRET纳米天线对单个溶酶体的酶分子活动监测。(A) rPRET纳米天线对单个溶酶体进行AzoR监测的示意图。(B) rPRET纳米天线对溶酶体膜进行光热破裂的示意图。(C, D) 癌细胞(C)和非癌细胞(D)提取的单个溶酶体进行AzoR检测的实验图像。比例尺:1 μm。(E) rPRET纳米天线检测单个癌细胞溶酶体的实时散射光谱变化。(F) 不同光功率密度下rPRET纳米天线的散射强度变化。(G) 不同细胞的单个溶酶体检测AzoR的实时散射强度变化。
乏氧条件下单个溶酶体的酶分子活动监测
乏氧是肿瘤、缺血性心脏病及血管病变等多种疾病的共同特征,氧供应不足会显著影响细胞代谢并诱导酶活性异常。本研究基于 rPRET 纳米天线建立了单个溶酶体水平的乏氧酶活动监测体系,实现了在乏氧微环境中酶分子活动的高灵敏、动态检测。研究结果表明,rPRET 纳米天线可经内吞作用精准进入溶酶体,并在低氧条件下表现出显著的散射增强,揭示 AzoR 活性随氧浓度下降而显著升高,呈典型的氧依赖性响应。该体系在单细胞器分辨率下揭示了氧浓度调控酶活性的动态规律,为阐明乏氧相关代谢调控及肿瘤微环境适应机制提供了新工具与研究思路。
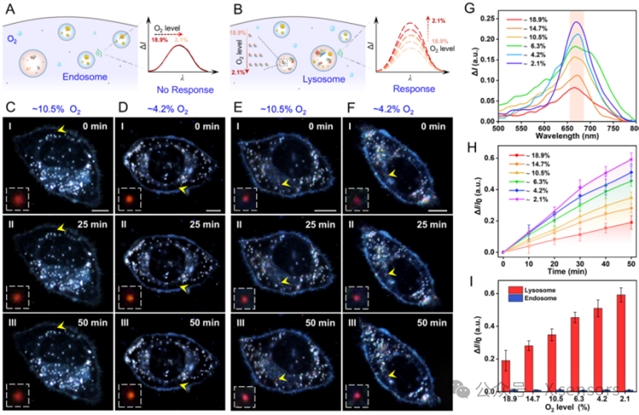
图3. rPRET纳米天线在活细胞单个细胞器中进行乏氧介导的AzoR检测。(A,B) 在单个内体(A)和单个溶酶体(B)中由rPRET纳米天线捕获不同O2水平的酶分子活动示意图。(C,D) 在氧气浓度10.5% (C)和4.2% (D)下,实时检测内体中乏氧介导的AzoR暗场图。(E,F) 在氧气浓度10.5% (E)和4.2% (F)下,实时检测溶酶体中乏氧介导的AzoR暗场图。比例尺:10 μm。(G) rPRET纳米天线在溶酶体中检测到的不同O2水平下的散射光谱差异。(H) 在不同O2水平下,溶酶体中检测到的实时散射强度变化。(I) 不同O2水平下内体、溶酶体散射强度变化的比较。
内体-溶酶体融合过程中酶分子活动的动态监测
细胞器间的动态相互作用是细胞生命活动的重要特征,其中内体–溶酶体途径在维持细胞稳态与代谢调控中起关键作用。本研究基于rPRET纳米天线的高灵敏成像能力,首次实现了内体–溶酶体融合过程中酶分子活动的长期动态监测,揭示了细胞在不同生理状态下的细胞器相互作用差异。研究结果表明,完整细胞中AzoR活性主要在融合后显著增强,而在凋亡细胞中,由于溶酶体膜通透性增加,酶提前泄漏至内体,出现融合前酶活性增强的“酶逃逸”现象。该特征可作为区分细胞生理状态的重要标志。进一步研究发现,乏氧条件下能量供应不足会延迟内体–溶酶体融合,并在凋亡细胞中表现更为明显,表明在乏氧条件下,细胞能量供应不足直接影响了依赖于能量的膜融合过程,进而改变了细胞器相互作用的动力学特征。
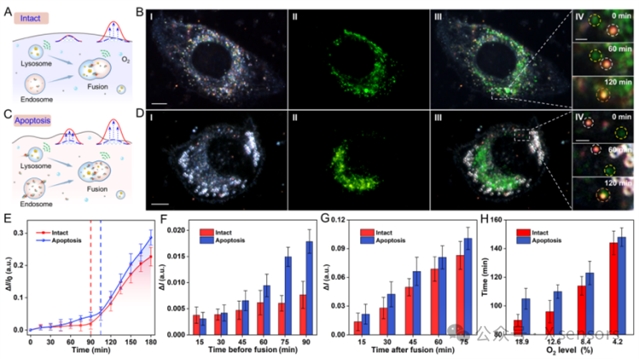
图4. rPRET纳米天线动态监测内体-溶酶体融合期间的酶活动。(A,C) 完整细胞(A)和凋亡细胞(C)中内体-溶酶体融合期间的酶活性检测示意图。(B,D) 完整细胞(B)和凋亡细胞(D)中内体-溶酶体融合期间酶活性动态监测的实验图像。图I-III显示暗场、荧光、暗场-荧光合并图像,比例尺:10 μm。图IV显示了内体-溶酶体融合过程的代表性图像。比例尺:1 μm。(E) 纳米天线散射强度随时间的变化,红色和蓝色虚线表示完整和凋亡细胞中内体和溶酶体的融合时间。(F) 完整细胞和凋亡细胞中内体-溶酶体融合前检测到的散射光谱差异的比较。(G) 完整细胞和凋亡细胞中内体-溶酶体融合后检测到的散射光谱差异的比较。(H) 比较不同氧气水平下完整细胞和凋亡细胞中内体-溶酶体融合的时间。
— 总结 —
本研究开发了一种新型反向等离激元共振能量转移(rPRET)纳米天线,实现了单细胞器水平对内体–溶酶体途径中酶分子活动的长期动态监测。该体系基于海胆状金纳米颗粒与黑洞猝灭分子的能量转移机制,利用 AzoR 特异性切割偶氮键触发能量恢复,从而实现对酶分子活动的高灵敏实时检测。
研究揭示了癌细胞与非癌细胞间的酶活性异质性,建立了氧浓度与酶活性的关系,并发现氧浓度可调控内体–溶酶体融合动力学。与传统荧光探针相比,rPRET 纳米天线具有优异的光稳定性和信噪比,可在无光漂白和无标记条件下长时追踪细胞事件而不干扰细胞生理状态。
该技术在空间分辨率、灵敏度和稳定性方面均表现突出,为解析细胞器相互作用与代谢调控机制提供了新工具,并在早期疾病诊断、药物筛选和细胞功能研究中具有广阔应用前景。
原文链接:
Long-Term Monitoring of Enzymatic Activity at the Single-Organelle Level via Reversed Plasmonic Resonance Energy Transfer | ACS Nano
撰稿人:
四川大学机械工程学院分析仪器研究中心 张学圆
责任编辑:四川大学机械工程学院分析仪器研究中心 罗泽伟
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。