|
|
|
|
|
FMD | 精彩荐读:GID复合体通过去稳定化TET2调控神经干细胞分化 |
|
|
论文标题:GID complex regulates the differentiation of neural stem cells by destabilizing TET2
期刊: Frontiers of Medicine
作者:Meiling Xia, Rui Yan, Wenjuan Wang, Meng Zhang, Zhigang Miao, Bo Wan, Xingshun Xu
发表时间: 15 Dec 2023
DOI:10.1007/s11684-023-1007-9
微信链接:点击此处阅读微信文章
导 读
苏州大学神经科学研究所徐兴顺和万波等在Frontiers of Medicine发表研究论文《GID复合体通过去稳定化TET2调控神经干细胞分化》(GID complex regulates the differentiation of neural stem cells by destabilizing TET2)。本研究发现,GID复合体通过泛素-蛋白酶体途径降解TET2蛋白,调控神经干细胞的分化,为解析脑发育分子机制及相关疾病病理提供了新依据。
在神经发育过程中,神经干细胞需要在自我更新与分化之间保持精细平衡,这依赖于基因表达的精准调控。作为重要的表观遗传因子,TET2通过催化DNA中5-甲基胞嘧啶(5mC)羟甲基化为5-羟甲基胞嘧啶(5hmC)来调节基因表达,并参与神经元分化过程。尽管已有研究揭示了TET2在神经发生、抑郁症及阿尔茨海默病等中枢神经系统生理病理过程中的作用,但其在神经干细胞分化过程中的调控机制仍不明确。另一方面,葡萄糖诱导降解缺陷(GID)复合体作为进化保守的泛素连接酶复合体,其核心亚基(如WDR26、ARMC8)的突变与精神发育迟滞、自闭症谱系障碍等神经系统疾病相关,但该复合体在中枢神经系统中的功能及作用机制尚未被深入探索。
苏州大学神经科学研究所徐兴顺和万波等通过一项研究揭示了GID复合体通过泛素化降解TET2调控神经干细胞分化的新机制。该研究不仅阐明了TET2蛋白稳定性的调控规律,还为理解脑发育的分子机制提供了新视角。
为探究TET2在神经分化中的调控机制,研究团队首先提取了野生型小鼠的神经干细胞并诱导其分化,检测发现,分化后的神经干细胞中Tet2的mRNA水平显著上调;但其蛋白水平却明显下降。这种“转录-翻译”不一致的现象提示可能存在翻译后调控的机制。为明确具体调控途径,研究人员使用蛋白酶体抑制剂(MG132)、钙蛋白酶抑制剂(calpeptin)及凋亡抑制剂(Z-VAD-FMK)处理人类胚胎肾(HEK293t)细胞、小鼠脑神经瘤(N2a)细胞和小鼠海马神经元(HT22)细胞,结果发现仅蛋白酶体抑制剂能显著抑制TET2的降解(图1),表明蛋白酶体途径是TET2蛋白水平下调的主要机制。
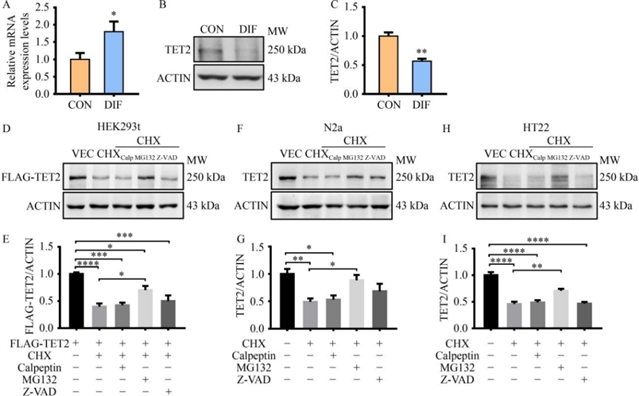
图1 蛋白酶体途径是影响TET2稳定性的主要途径
接下来,研究团队通过质谱分析筛选TET2的互作蛋白,发现GID复合体的多个亚基与TET2存在潜在相互作用。进一步通过外源性共转染人类胚胎肾细胞后进行免疫共沉淀实验,以及内源性小鼠脑神经瘤细胞裂解物免疫共沉淀实验,证实TET2能与GID复合体核心亚基WDR26、ARMC8直接结合(图2),提示GID复合体可能作为泛素连接酶参与TET2的泛素化降解。
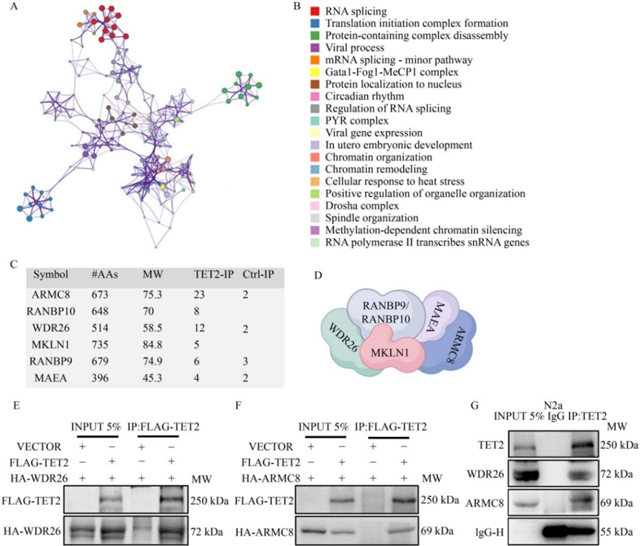
图2 TET2与GID复合体亚基WDR26和ARMC8相互作用
为验证这一假设,研究团队分析了神经干细胞分化过程中GID复合体亚基的表达变化:在诱导分化的神经干细胞中,GID复合体核心亚基的mRNA和蛋白水平均显著上调,与TET2蛋白水平呈反向变化趋势;类似现象也出现在诱导分化的小鼠脑神经瘤细胞中(图3)。进一步通过CRISPR/Cas9技术敲除小鼠脑神经瘤细胞中的Armc8或Wdr26后,TET2蛋白水平显著升高,而TET1、TET3蛋白水平未受影响;过表达ARMC8或WDR26则可降低TET2蛋白水平。泛素化实验显示,过表达GID复合体亚基会增加TET2的泛素化修饰,而敲除Armc8或Wdr26则延长了TET2的蛋白半衰期(图4)。这些结果表明,GID复合体通过泛素-蛋白酶体途径直接调控TET2的蛋白稳定性。
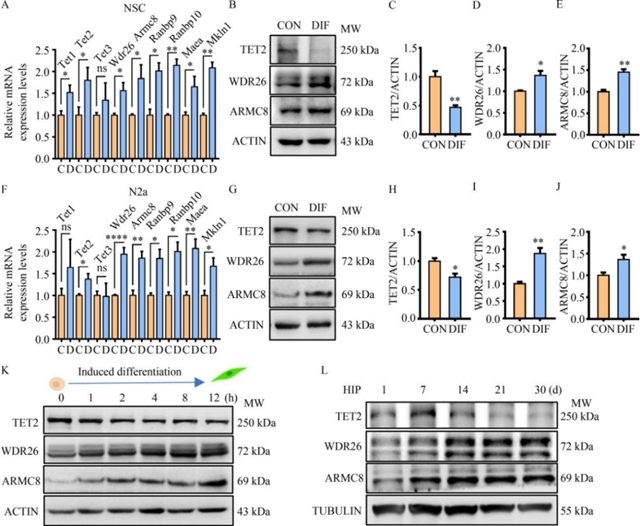
图3 TET2-GID复合体参与神经元分化
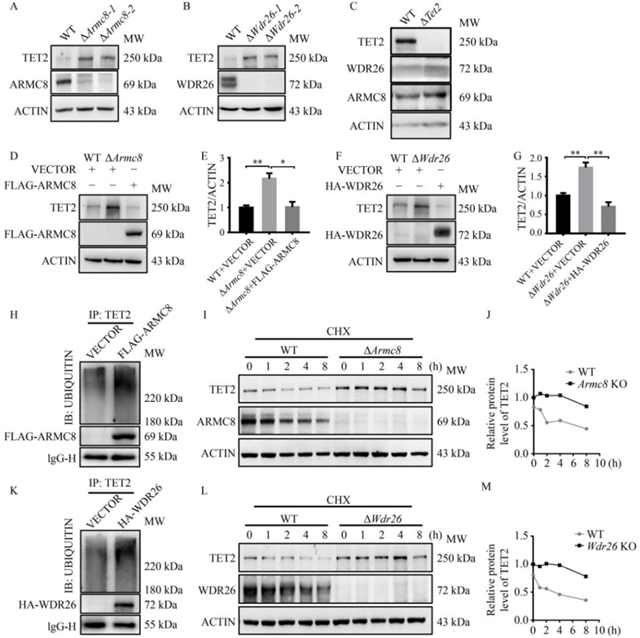
图4 TET2是GID复合体的直接底物
研究团队进一步探讨了这一调控机制对神经干细胞分化的影响。敲除Armc8或Wdr26后,小鼠脑神经瘤细胞的5-羟甲基胞嘧啶水平显著升高(图5),神经分化比例增加,轴突长度延长。在野生型神经干细胞中敲低Armc8或Wdr26可促进分化标志物TUJ1的表达,但这一效应在Tet2条件性敲除的神经干细胞中消失(图6),说明GID复合体对神经分化的调控依赖于TET2。此外,在Wdr26杂合敲除小鼠的前额叶皮层中,TET2蛋白水平显著升高,进一步支持了GID复合体对TET2的负调控作用。
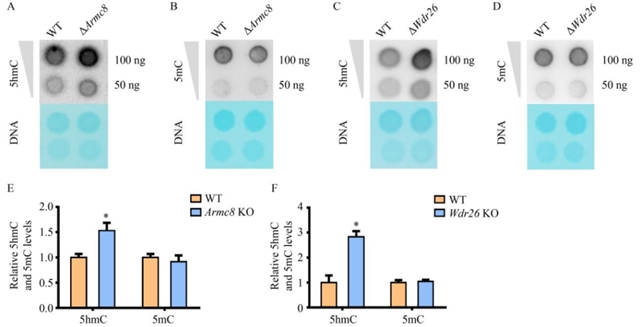
图5 GID复合体亚基缺失促进DNA 5-羟甲基化
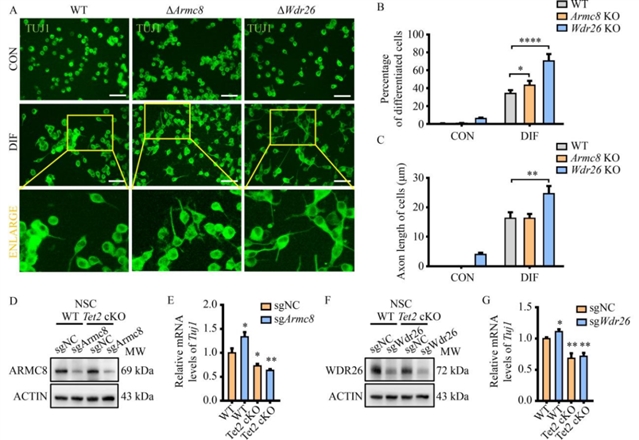
图6 GID复合体亚基缺失促进神经元分化过程
这项研究揭示了GID复合体作为TET2的新型泛素连接酶,通过调控其蛋白稳定性影响DNA羟甲基化水平,最终参与神经干细胞分化命运决定的分子机制。该发现为理解GID复合体亚基突变相关神经系统疾病的病理机制提供了线索。未来研究可进一步探索GID复合体-TET2轴在神经发育相关疾病中的具体作用,为相关疾病的治疗靶点开发提供理论依据。
原文信息
标题
GID complex regulates the differentiation of neural stem cells by destabilizing TET2
作者
Meiling Xia1,2, Rui Yan2, Wenjuan Wang2, Meng Zhang2, Zhigang Miao2, Bo Wan2, Xingshun Xu1,2,3
机构
1. Department of Neurology, The First Affiliated Hospital of Soochow University, Suzhou 215006, China
2. Institute of Neuroscience, Soochow University, Suzhou 215006, China
3. Jiangsu Key Laboratory of Neuropsychiatric Diseases, Soochow University, Suzhou 215123, China
通讯作者
Bo Wan, Xingshun Xu
引用这篇文章
Meiling Xia, Rui Yan, Wenjuan Wang, Meng Zhang, Zhigang Miao, Bo Wan, Xingshun Xu. GID complex regulates the differentiation of neural stem cells by destabilizing TET2. Front. Med., 2023, 17(6): 1204–1218
https://doi.org/10.1007/s11684-023-1007-9
https://journal.hep.com.cn/fmd/EN/10.1007/s11684-023-1007-9
https://link.springer.com/article/10.1007/s11684-023-1007-9
感谢作者对Frontiers of Medicine的信任和支持。
期刊简介
Frontiers of Medicine是中国工程院院刊,由教育部主管,高等教育出版社、中国工程院与上海交通大学医学院附属瑞金医院共同主办。期刊聚焦医学前沿领域的学术进展,关注国际研究热点与中国优秀研究成果,主编为陈赛娟院士、张伯礼院士和王小凡院士。主要报道领域涵盖临床医学、基础医学、转化医学、流行病学、公共卫生、中医药学和人工智能医学等,刊载文章类型包括Research Article、Review、Perspective、Editorial、Case Report、Comment、Letter等。
期刊已被SCI、PubMed、Scopus、中国科技核心期刊、中国科学引文数据库(CSCD)核心库、第三批临床医学领域高质量科技期刊分级目录T1级、化学文摘数据库(CAS)等权威数据库收录,在2025中国科学院文献情报中心期刊分区表医学大类中位列二区。
在线浏览
https://journal.hep.com.cn/fmd
https://link.springer.com/journal/11684
投稿
https://mc.manuscriptcentral.com/fmd

《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。