|
|
|
|
|
FMD | 精彩荐读:长链非编码RNA LOC646029作为竞争性内源RNA抑制卵巢癌进展 |
|
|
论文标题:Long noncoding RNA LOC646029 functions as a ceRNA to suppress ovarian cancer progression through the miR-627-3p/SPRED1 axis
期刊: Frontiers of Medicine
作者:Pengfei Zhao, Yating Wang, Xiao Yu, Yabing Nan, Shi Liu, Bin Li, Zhumei Cui, Zhihua Liu
发表时间: 15 Oct 2023
DOI:10.1007/s11684-023-1004-z
微信链接:点击此处阅读微信文章
导 读
中国医学科学院肿瘤医院刘芝华、青岛大学崔竹梅等在Frontiers of Medicine发表研究论文《长链非编码RNA LOC646029作为竞争性内源RNA通过miR-627-3p/SPRED1轴抑制卵巢癌进展》(Long noncoding RNA LOC646029 functions as a ceRNA to suppress ovarian cancer progression through the miR-627-3p/SPRED1 axis)。本研究发现长链非编码RNA LOC646029通过作为miR-627-3p的分子海绵上调SPRED1表达,抑制卵巢癌细胞的增殖和转移,且其在转移灶中的低表达与患者预后不良相关。
卵巢癌是全球女性健康的重大威胁之一。根据世界卫生组织统计,2020年全球新增卵巢癌病例约31.4万例,死亡病例约20.7万例,其癌症相关死亡率在女性恶性肿瘤中位列第八。由于卵巢癌早期缺乏典型症状且缺乏有效的早期诊断手段,超过80%的患者初诊时已处于Ⅲ期或Ⅳ期,5年总生存率仅约30.8%。
长链非编码RNA(lncRNA)是一类长度超过200个核苷酸、不具备蛋白质编码能力的RNA分子。越来越多研究表明,这类分子通过染色质重编程、mRNA稳定性调控、翻译后修饰等多种机制参与癌症的发生发展,在细胞增殖、凋亡、代谢重编程、侵袭转移等过程中发挥关键作用。其中,作为微小RNA(miRNA)分子海绵的“竞争性内源RNA(ceRNA)”机制是其重要功能模式之一——通过与miRNA结合,减少miRNA对靶基因的抑制作用,从而调控相关信号通路。然而,关于lncRNA在卵巢癌转移中的具体作用及分子机制,仍有许多未知领域亟待探索。
中国医学科学院肿瘤医院刘芝华、青岛大学崔竹梅等聚焦于一个名为LOC646029的长链非编码RNA,系统揭示了其在卵巢癌转移中的抑制作用及潜在机制。相关成果发表于Frontiers of Medicine。
研究团队首先通过RNA测序技术分析了5对卵巢癌原发灶与转移灶组织中的lncRNA表达谱,发现LOC646029在转移灶中的表达较原发灶显著下调,这一结果在后续38对组织样本的实时荧光定量PCR验证中得到确认——超过78.9%的转移灶样本中LOC646029表达低于对应的原发灶。进一步分析卵巢癌细胞系及正常卵巢上皮细胞系IOSE80的表达水平发现,除3AO细胞外,多数卵巢癌细胞系中LOC646029表达高于正常细胞,提示其可能与肿瘤进展阶段相关。对150例卵巢癌患者的原位杂交(ISH)分析显示,LOC646029低表达与患者预后不良显著相关,初步提示其可能作为潜在的预后标志物(图1)。
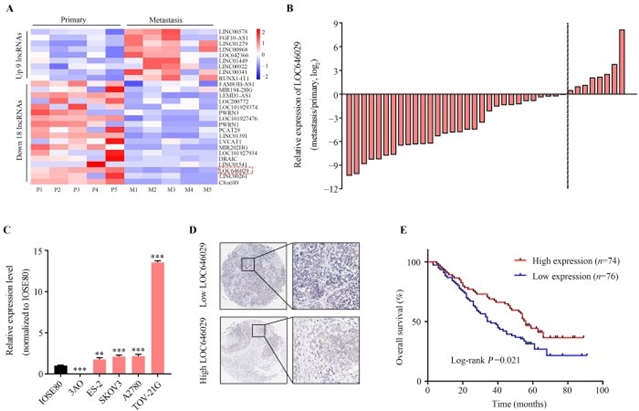
图1 LOC646029在卵巢癌转移灶中表达下调,并与卵巢癌预后呈负相关
为明确LOC646029的生物学功能,研究团队通过过表达和敲低实验开展功能验证。在3AO和ES-2细胞中过表达LOC646029后,细胞增殖能力显著下降;而在TOV-21G和A2780细胞中敲低LOC646029则促进增殖。Transwell侵袭迁移实验和划痕愈合实验进一步显示,过表达LOC646029可抑制卵巢癌细胞的侵袭和迁移能力,敲低则产生相反效果。体内实验中,过表达LOC646029的3AO细胞腹腔注射裸鼠后,转移结节数量和大小均显著减少,皮下成瘤实验也显示肿瘤生长受到抑制(图2)。这些结果共同表明,LOC646029在体内外均具有抑制卵巢癌增殖和转移的作用。
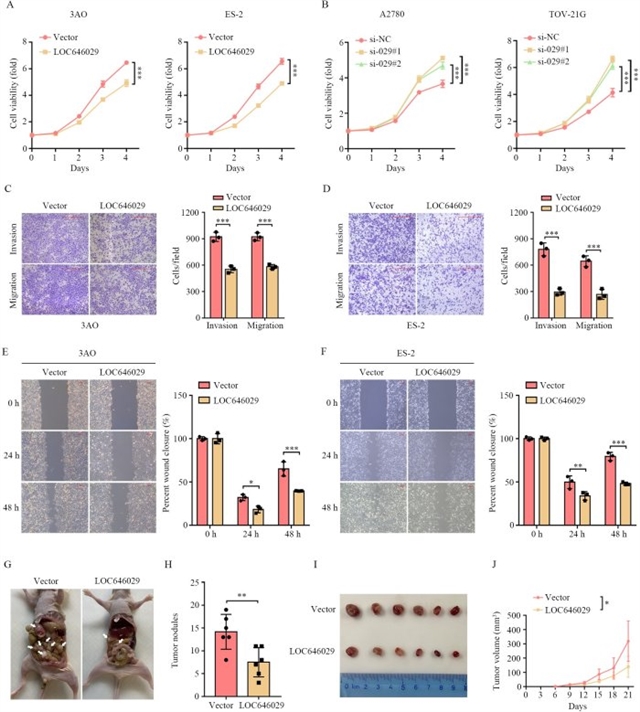
图2 LOC646029作为抑癌因子,在体内外抑制卵巢癌细胞的增殖和转移
机制探索方面,研究团队首先通过荧光原位杂交(FISH)和核质分离实验确认LOC646029主要定位于细胞质,提示其可能通过“分子海绵”机制调控miRNA功能。利用生物信息学工具预测并验证后,发现miR-627-3p是LOC646029的直接结合靶点:过表达LOC646029可显著降低miR-627-3p表达,敲低LOC646029则上调miR-627-3p水平;双荧光素酶报告实验证实,miR-627-3p与LOC646029的野生型序列结合可显著降低荧光素酶活性,而突变结合位点后这一效应消失;RNA免疫沉淀(RIP)实验进一步验证了LOC646029、miR-627-3p与Argonaute-2(AGO2)蛋白的共沉淀,支持二者通过RNA诱导沉默复合体(RISC)相互作用。功能实验显示,过表达miR-627-3p可促进卵巢癌细胞增殖、侵袭和迁移,敲低miR-627-3p则抑制这些恶性表型(图3),与LOC646029的作用相反。
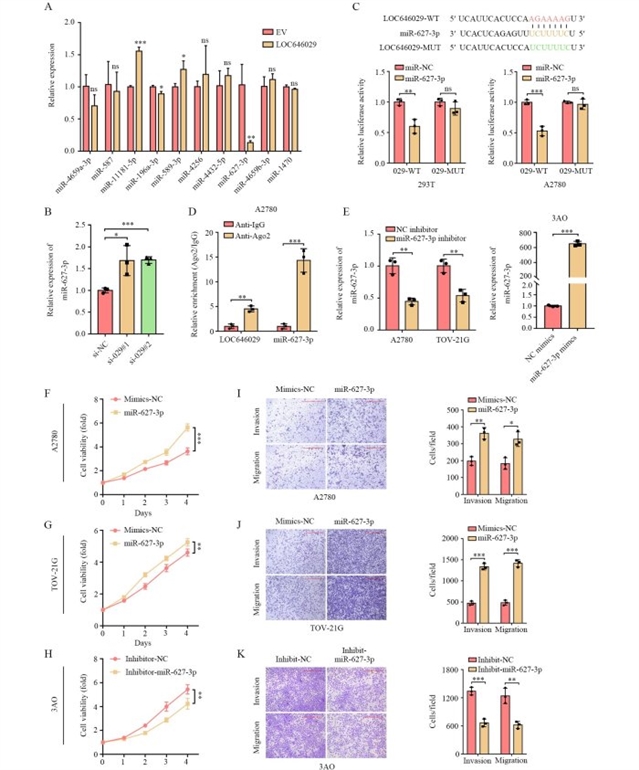
图3 miR-627-3p是LOC646029的直接靶标,可促进卵巢癌的转移和增殖
进一步研究发现,SPRED1(含EVH1结构域的Sprouty相关蛋白1)是miR-627-3p的下游靶基因。生物信息学预测结合RT-qPCR验证显示,miR-627-3p过表达可显著降低SPRED1的mRNA和蛋白水平;双荧光素酶报告实验证实,miR-627-3p通过结合SPRED1的3非翻译区(3UTR)调控其表达。回复实验表明,外源性过表达SPRED1可部分逆转miR-627-3p对细胞增殖、侵袭和迁移的促进作用(图4),提示SPRED1是miR-627-3p调控卵巢癌恶性表型的关键下游分子。
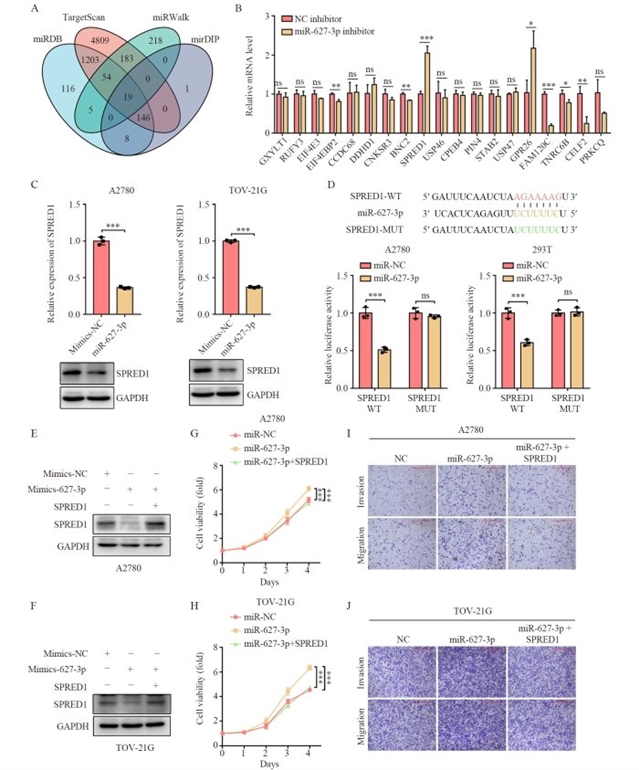
图4 SPRED1是miR-627-3p的关键下游靶标,可抑制卵巢癌细胞的增殖、侵袭和迁移
在此基础上,研究团队证实LOC646029通过“海绵”吸附miR-627-3p,解除后者对SPRED1的抑制,从而上调SPRED1表达。敲低LOC646029导致SPRED1表达下降,而miR-627-3p抑制剂可逆转这一效应;过表达LOC646029上调SPRED1表达,miR-627-3p模拟物则部分抵消该作用。功能实验显示,miR-627-3p抑制剂可缓解LOC646029敲低引起的增殖和侵袭能力增强,miR-627-3p模拟物则削弱LOC646029过表达的抑制效应。此外,LOC646029过表达的裸鼠移植瘤中SPRED1表达显著高于对照组,且TCGA数据库分析显示SPRED1低表达与卵巢癌患者预后不良相关(图5)。
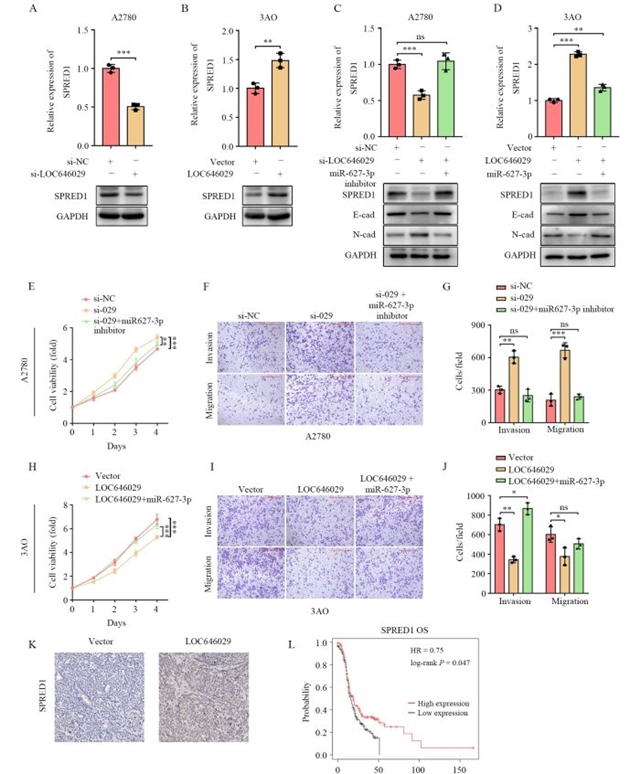
图5 LOC646029通过调控miR-627-3p/SPRED1信号通路抑制卵巢癌进展
深入的信号通路分析表明,LOC646029/miR-627-3p/SPRED1轴通过抑制KRAS/MAPK信号通路发挥作用。敲低LOC646029可激活ERK磷酸化(p-ERK),而miR-627-3p抑制剂可逆转这一效应;过表达LOC646029则降低p-ERK水平,miR-627-3p模拟物可部分恢复。基因集富集分析(GSEA)进一步证实,LOC646029表达与上皮间质转化(EMT)和KRAS信号通路呈负相关(图6)。
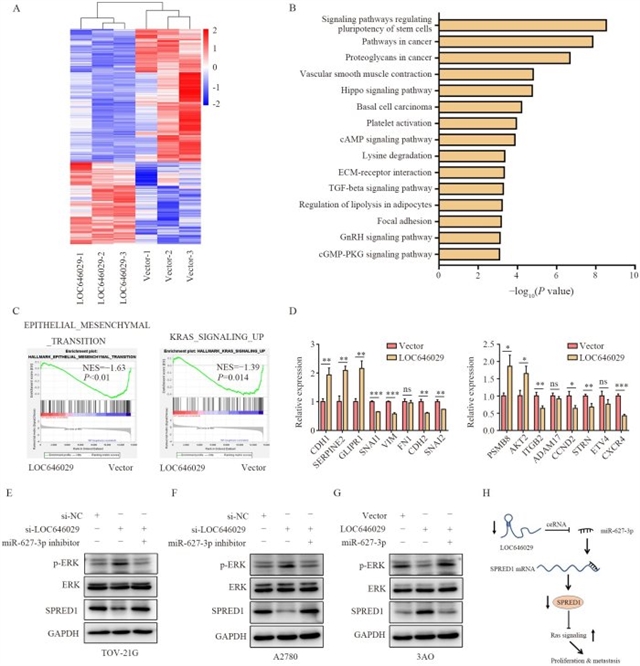
图6 LOC646029/miR-627-3p/SPRED1轴通过抑制Ras信号通路抑制卵巢癌细胞的进展
本研究系统揭示了LOC646029通过“LOC646029/miR-627-3p/SPRED1”轴抑制卵巢癌增殖和转移的分子机制,为理解卵巢癌转移的调控网络提供了新视角。研究发现LOC646029在转移灶中的低表达与患者预后不良相关,提示其可能作为卵巢癌进展的潜在预后标志物。不过,研究也指出,尽管LOC646029在卵巢癌转移中显示出重要作用,其临床应用仍需更大样本量的验证,且开发非侵入性检测方法以满足临床动态监测需求仍是未来研究的重要方向。
原文信息
标题
Long noncoding RNA LOC646029 functions as a ceRNA to suppress ovarian cancer progression through the miR-627-3p/SPRED1 axis
作者
Pengfei Zhao1, Yating Wang2, Xiao Yu1, Yabing Nan1, Shi Liu1, Bin Li2, Zhumei Cui3, Zhihua Liu1
机构
1. State Key Laboratory of Molecular Oncology, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
2. Department of Gynecological Oncology, National Cancer Center/National Clinical Research Center for Cancer/Cancer Hospital, Chinese Academy of Medical Sciences and Peking Union Medical College, Beijing 100021, China
3. Department of Obstetrics and Gynecology, The Affiliated Hospital of Qingdao University, Qingdao 266000, China
通讯作者
Zhumei Cui, Zhihua Liu
引用这篇文章
Pengfei Zhao, Yating Wang, Xiao Yu, Yabing Nan, Shi Liu, Bin Li, Zhumei Cui, Zhihua Liu. Long noncoding RNA LOC646029 functions as a ceRNA to suppress ovarian cancer progression through the miR-627-3p/SPRED1 axis. Front. Med., 2023, 17(5): 924–938
https://doi.org/10.1007/s11684-023-1004-z
https://journal.hep.com.cn/fmd/EN/10.1007/s11684-023-1004-z
https://link.springer.com/article/10.1007/s11684-023-1004-z
感谢作者对Frontiers of Medicine的信任和支持。
期刊简介
Frontiers of Medicine是中国工程院院刊,由教育部主管,高等教育出版社、中国工程院与上海交通大学医学院附属瑞金医院共同主办。期刊聚焦医学前沿领域的学术进展,关注国际研究热点与中国优秀研究成果,主编为陈赛娟院士、张伯礼院士和王小凡院士。主要报道领域涵盖临床医学、基础医学、转化医学、流行病学、公共卫生、中医药学和人工智能医学等,刊载文章类型包括Research Article、Review、Perspective、Editorial、Case Report、Comment、Letter等。
期刊已被SCI、PubMed、Scopus、中国科技核心期刊、中国科学引文数据库(CSCD)核心库、第三批临床医学领域高质量科技期刊分级目录T1级、化学文摘数据库(CAS)等权威数据库收录,在2025中国科学院文献情报中心期刊分区表医学大类中位列二区。
在线浏览
https://journal.hep.com.cn/fmd
https://link.springer.com/journal/11684
投稿
https://mc.manuscriptcentral.com/fmd

《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。