|
|
|
|
|
FMD | 精彩荐读:m6A阅读蛋白YTHDF1通过增强AXL翻译促进心肌纤维化 |
|
|
论文标题:m6A reader YTHDF1 promotes cardiac fibrosis by enhancing AXL translation
期刊: Frontiers of Medicine
作者:Han Wu, Weitao Jiang, Ping Pang, Wei Si, Xue Kong, Xinyue Zhang, Yuting Xiong, Chunlei Wang, Feng Zhang, Jinglun Song, Yang Yang, Linghua Zeng, Kuiwu Liu, Yingqiong Jia, Zhuo Wang, Jiaming Ju, Hongtao Diao, Yu Bian, Baofeng Yang
发表时间:15 Jun 2024
DOI:10.1007/s11684-023-1052-4
微信链接:点击此处阅读微信文章
导 读
哈尔滨医科大学药学院杨宝峰、卞宇、Hongtao Diao等在Frontiers of Medicine发表研究论文《m6A阅读蛋白YTHDF1通过增强AXL翻译促进心肌纤维化》(m6A reader YTHDF1 promotes cardiac fibrosis by enhancing AXL translation)。本研究发现m6A阅读蛋白YTHDF1在心肌梗死后的心脏中表达上调,通过增强AXL信使RNA的翻译效率,激活TGF-β-Smad2/3信号通路,从而促进心脏纤维化的发生与发展。
在心血管疾病领域,心肌纤维化是心肌梗死等损伤后常见的病理改变,其特征是心脏成纤维细胞过度活化、细胞外基质蛋白异常沉积,最终导致心脏结构重塑和功能下降,进而引发心力衰竭。尽管转录调控在心肌纤维化中的作用已被广泛研究,转录后调控机制,尤其是RNA修饰在这一过程中的作用仍知之甚少。N6-甲基腺苷(m6A)作为信使RNA上最常见的化学修饰之一,参与调控RNA的稳定性、剪接、出核及翻译等过程,其在心血管疾病中的功能正逐渐受到关注。m6A阅读蛋白YTHDF1被认为能够促进特定mRNA的翻译效率,但其在心肌纤维化中的具体作用尚未明确。
哈尔滨医科大学药学院杨宝峰、卞宇、Hongtao Diao等系统探讨了YTHDF1在心肌纤维化发生发展中的功能及其分子机制。本研究综合运用了在体心肌梗死模型和体外转化生长因子-β诱导的心脏成纤维细胞活化模型,结合腺相关病毒介导的基因敲降与过表达技术,揭示了YTHDF1通过增强受体酪氨酸激酶(AXL)的翻译,进而激活TGF-β–Smad2/3信号通路,从而促进心肌纤维化的新机制。
研究首先发现,在小鼠心肌梗死后的心脏组织中,YTHDF1的表达显著上升(图1)。进一步在分离培养的新生及成年小鼠心脏成纤维细胞中,经TGF-β刺激后,YTHDF1在信使RNA和蛋白水平上也均呈现明显上调,提示YTHDF1可能参与心肌损伤后的纤维化反应。
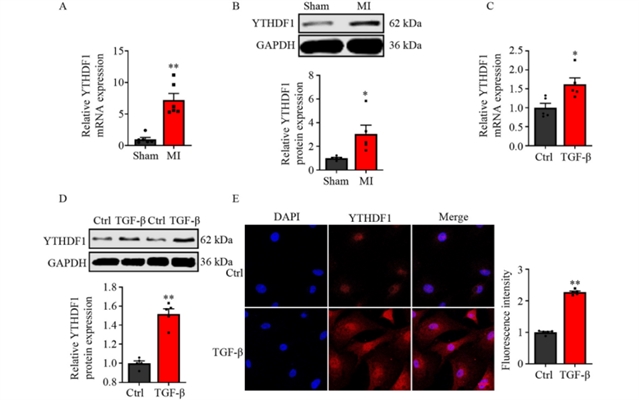
图1 心肌梗死术后4周及TGF-β处理后YTHDF1表达的变化
为明确YTHDF1在心肌纤维化中的功能,研究团队利用AAV9病毒载体在小鼠心脏中特异性敲降YTHDF1。结果显示,敲降YTHDF1能够显著改善心肌梗死后的心功能指标,包括提高射血分数和短轴缩短率,并减少左心室舒张末和收缩末内径(图2)。组织学染色进一步证实,YTHDF1敲降有效减轻了心肌纤维化面积和心脏重量指数,同时显著降低了包括α-平滑肌肌动蛋白、Ⅰ型胶原、Ⅲ型胶原及结缔组织生长因子在内的纤维化标志物的表达。相反,过表达YTHDF1则进一步加剧了心功能恶化与纤维化程度,说明YTHDF1在心肌纤维化中具有促进作用。
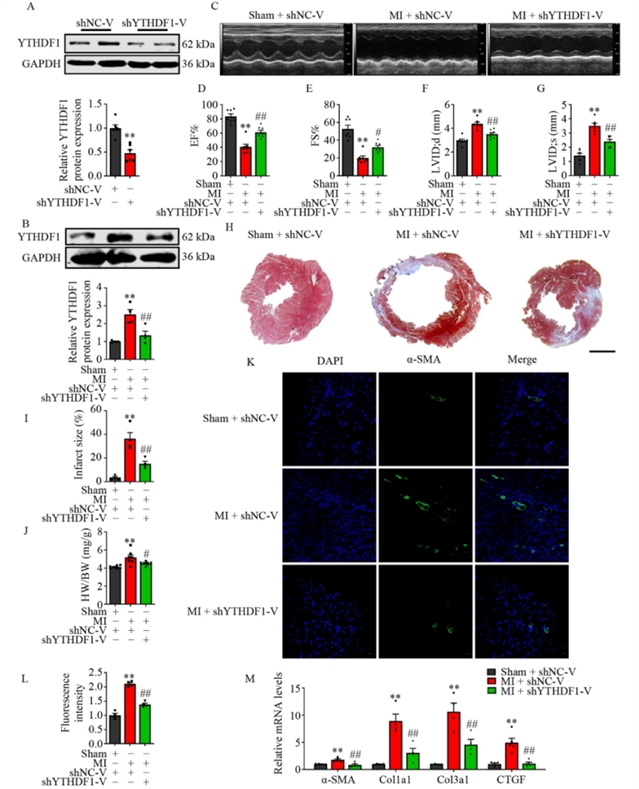
图2 抑制YTHDF1可逆转小鼠心肌梗死诱导的心肌纤维化
在体外实验中,研究人员通过小干扰RNA敲降YTHDF1,发现其可显著抑制TGF-β诱导的心脏成纤维细胞活化,表现为细胞活力、增殖能力与迁移能力的下降,以及纤维化标志物表达的降低(图3)。这些结果进一步支持YTHDF1在调控成纤维细胞功能中的关键作用。
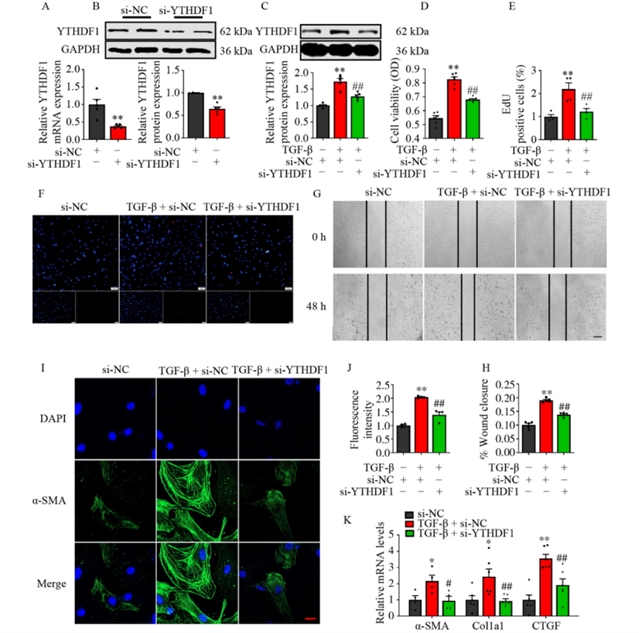
图3 抑制YTHDF1可阻止TGF-β诱导的新生小鼠心肌成纤维细胞体外激活
机制探索方面,研究者通过生物信息学预测并结合实验验证,发现转录因子ZBED6能够直接结合YTHDF1基因启动子区域并抑制其转录活性(图4)。在心肌梗死或TGF-β刺激下,ZBED6表达下降,从而解除了对YTHDF1的抑制,导致其表达上升。随后的蛋白质组学分析提示,受体酪氨酸激酶AXL可能是YTHDF1的下游靶标。实验证实,YTHDF1能够识别AXL信使RNA上的m6A修饰位点,并通过提高其翻译效率来增加AXL蛋白的表达(图5)。此外,YTHDF1的敲降或过表达可相应降低或升高TGF-β1的表达及Smad2/3磷酸化水平,表明YTHDF1–AXL轴参与激活了经典的TGF-β–Smad2/3纤维化信号通路。更为重要的是,在YTHDF1过表达背景下,敲降AXL能够逆转由YTHDF1引起的心脏成纤维细胞增殖、迁移及纤维化基因表达的上调(图6),说明AXL是YTHDF1发挥作用的关键效应分子。
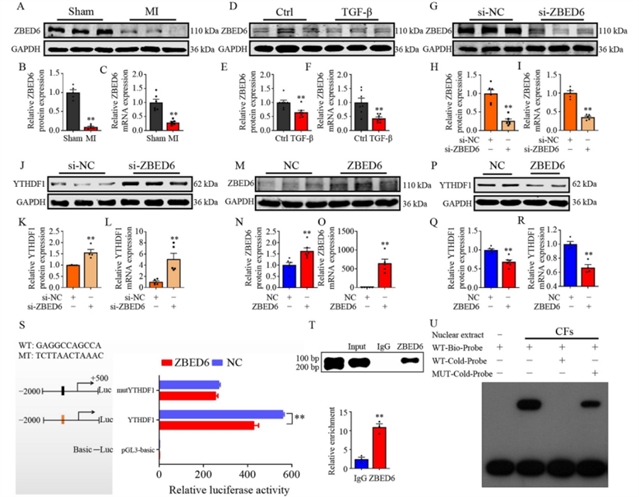
图4 ZBED6调控YTHDF1的表达
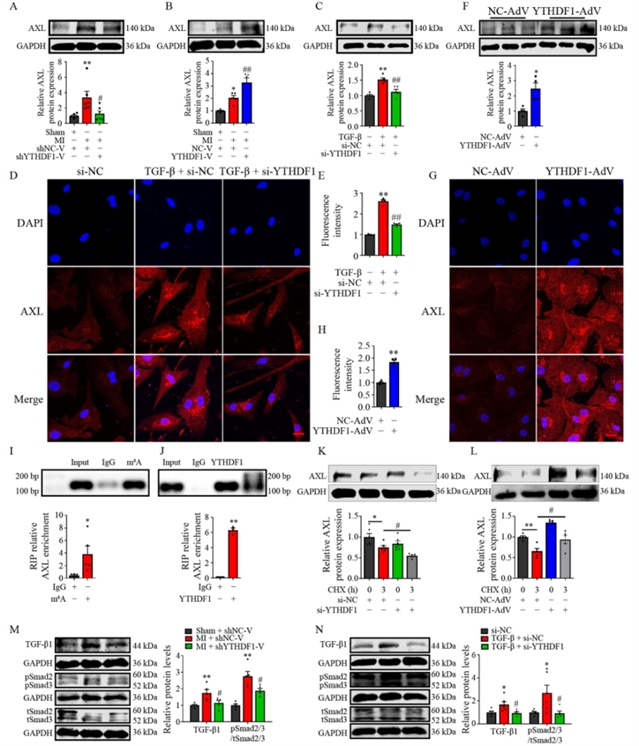
图5 YTHDF1通过促进AXL翻译激活TGF-β/Smad信号通路
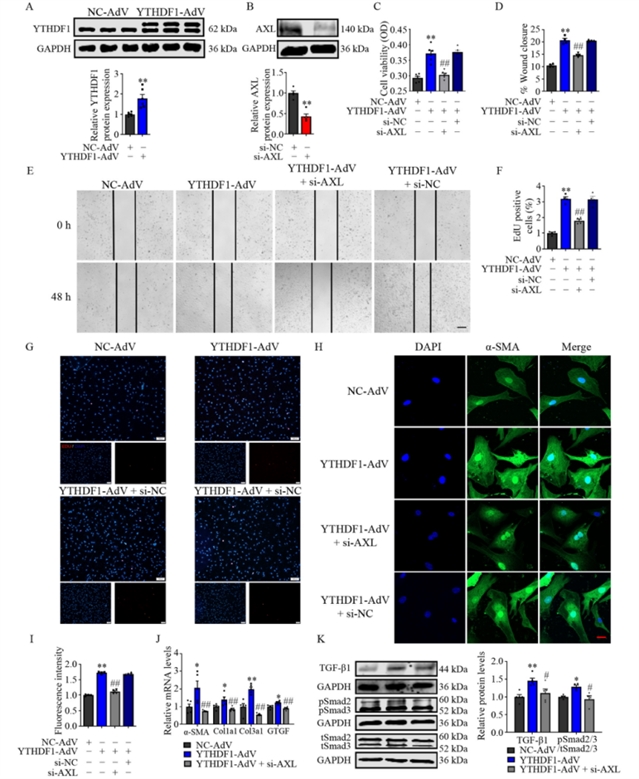
图6 YTHDF1通过靶向AXL在体外刺激心肌纤维化
本研究不仅系统揭示了YTHDF1作为m6A阅读器在心肌纤维化中的促纤维化作用,还构建了一条从ZBED6转录抑制到YTHDF1介导的AXL翻译激活,最终通过TGF-β–Smad2/3信号通路驱动心肌纤维化的完整调控轴。这一发现深化了对m6A修饰在心脏疾病中功能的理解,也为临床开发针对心肌纤维化和心力衰竭的新型治疗策略提供了潜在靶点,提示YTHDF1可能成为干预病理性心脏重构的候选分子。
原文信息
标题
m6A reader YTHDF1 promotes cardiac fibrosis by enhancing AXL translation
作者
Han Wu, Weitao Jiang, Ping Pang, Wei Si, Xue Kong, Xinyue Zhang, Yuting Xiong, Chunlei Wang, Feng Zhang, Jinglun Song, Yang Yang, Linghua Zeng, Kuiwu Liu, Yingqiong Jia, Zhuo Wang, Jiaming Ju, Hongtao Diao, Yu Bian, Baofeng Yang
机构
Department of Pharmacology (National Key Laboratory of Frigid Zone Cardiovascular Diseases, the State-Province Key Laboratories of Biomedicine-Pharmaceutics of China, Key Laboratory of Cardiovascular Research, Ministry of Education), College of Pharmacy, Harbin Medical University, Harbin 150081, China
通讯作者
Hongtao Diao, Yu Bian, Baofeng Yang
引用这篇文章
Han Wu, Weitao Jiang, Ping Pang, Wei Si, Xue Kong, Xinyue Zhang, Yuting Xiong, Chunlei Wang, Feng Zhang, Jinglun Song, Yang Yang, Linghua Zeng, Kuiwu Liu, Yingqiong Jia, Zhuo Wang, Jiaming Ju, Hongtao Diao, Yu Bian, Baofeng Yang. m6A reader YTHDF1 promotes cardiac fibrosis by enhancing AXL translation. Front. Med., 2024, 18(3): 499-515
https://doi.org/10.1007/s11684-023-1052-4
https://journal.hep.com.cn/fmd/EN/10.1007/s11684-023-1052-4
https://link.springer.com/article/10.1007/s11684-023-1052-4
感谢作者对Frontiers of Medicine的信任和支持。
期刊简介
Frontiers of Medicine是中国工程院院刊,由教育部主管,高等教育出版社、中国工程院与上海交通大学医学院附属瑞金医院共同主办。期刊聚焦医学前沿领域的学术进展,关注国际研究热点与中国优秀研究成果,主编为陈赛娟院士、张伯礼院士和王小凡院士。主要报道领域涵盖临床医学、基础医学、转化医学、流行病学、公共卫生、中医药学和人工智能医学等,刊载文章类型包括Research Article、Review、Perspective、Editorial、Case Report、Comment、Letter等。
期刊已被SCI、PubMed、Scopus、中国科技核心期刊、中国科学引文数据库(CSCD)核心库、第三批临床医学领域高质量科技期刊分级目录T1级、化学文摘数据库(CAS)等权威数据库收录,在2025中国科学院文献情报中心期刊分区表医学大类中位列二区。
在线浏览
https://journal.hep.com.cn/fmd
https://link.springer.com/journal/11684
投稿
https://mc.manuscriptcentral.com/fmd
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。