导读
多维度同步检测活细胞信息在生物医学研究中具有重要意义。然而,现有光学成像方法在形态学量化、代谢状态评估以及外源性小分子摄取监测方面往往各自独立,难以同时从同一细胞中一致性的数据集。特别是在光动力治疗(PDT)等涉及快速光生理反应的研究中,缺乏能够同时记录形态与代谢变化的成像体系显著限制了细胞死亡机制的精确解析。
为了检索到分子水平或细胞/组织水平上的互补数据,将不同的实验技术整合到一个成像复合体中,从而利用多模态成像系统多维度地分析细胞内的动态变化是我们的核心目标。
近日,俄罗斯科学院约飞物理技术研究所Irina V. Semenova团队创新性地构建了一个结合定量相位成像(QPI)与荧光寿命成像(FLIM)的多模态显微系统。实现了两种成像模式的光路整合与同步触发,能够同时获得细胞的光学厚度分布、体积、干质量等形态参数,以及 NADH、FAD 与光敏剂 Radachlorin 的时间分辨荧光特征。该成果发表在Light: Advanced Manufacturing,题为QPI- and FLIM-assisted multimodal analysis of the dynamics of morphological and physiological parameters of cells。
该系统使得形态变化、代谢动态及光敏剂摄取行为能够在同一细胞中以完全同步的方式记录,为研究细胞损伤机制、能量代谢调控与光动力治疗机制提供了一种强有力的工具,也为未来的无损细胞诊断与个性化治疗评估奠定了技术基础。
小百科:定量相位成像 (QPI) &荧光寿命成像 (FLIM)?
定量相位成像(QPI)是基于光学干涉或数字全息技术,通过精确测量样品对入射光波前产生的相位延迟,实现对透明或弱散射生物样品的光学路径长度进行量化的一类成像方法。
通过相位信息可以反演得到细胞的厚度分布、折射率分布、干质量等物理量,从而实现无标记、定量的细胞结构与动态监测的功能。
荧光寿命成像(FLIM)是一种基于时间分辨荧光技术,通过测量荧光分子被激发后发射光子的衰减时间(即荧光寿命,τ),并将其空间分布转化为成像信号的功能成像技术。
原理:荧光分子受激发后从激发态返回基态时会释放荧光,不同分子的荧光寿命由其固有属性(如分子结构)和微环境(如 pH 值、离子浓度、分子相互作用)决定。
技术方案:构建QPI & FLIM的多模态系统
该多模态光学成像系统的实验装置如图1所示,该装置基于倒置的尼康Ti2-A显微镜(中),配备了两个连接到显微镜两个输出端口的外围通道,用于时间分辨荧光(FLIM)测量(上)和相位(QPI)测量(下)。
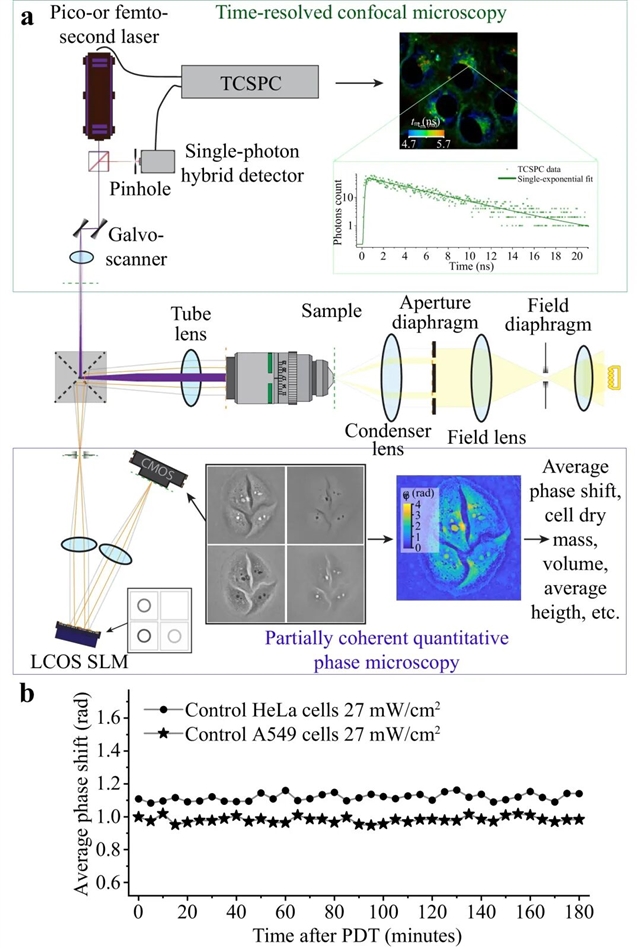
图1:多模态光学成像系统示意图
工作原理:QPI 通过空间光调制器(SLM)实现相位步进,获取光学厚度、干质量、细胞体积等结构参数;FLIM利用飞秒/皮秒激光源分时激发 NADH、FAD 与 Radachlorin,实现纳秒级荧光寿命分辨。核心优势在于:所有数据来自完全相同的单个细胞,无时序误差。
核心实验:揭示 PDT 过程中的多维动态变化
1 细胞形态评估:QPI 监测了 PDT 过程中细胞的“死亡路径图谱”
形态收缩、干质量下降 → 走向凋亡;细胞膨胀、体积急剧上升 → 走向坏死
QPI 结果显示,A549 与 HeLa 细胞在体积上相近,但平均厚度存在显著差异(A549的平均厚度约为5.6 μm,HeLa则比平均值厚了约为1.9 μm)。如图2左侧所示,基于 SLIM 与 AO-3D 成像对比,形态参数在两种方法间高度一致,证实了系统的量化可靠性。
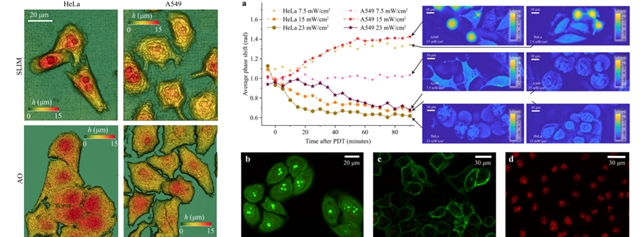
图2:SLIM观测细胞形态变化图
进一步通过负载光敏剂Radachlorin后分别对两种细胞给予不同功率的辐射,观测 HeLa 和 A549 细胞的平均相移动态变化。如图2右侧所示:当功率密度为 7.5mW/cm2 时,A549 细胞无明显形态变化,但诱导 HeLa 细胞凋亡;当功率密度增加到 15mW/cm2时,A549 细胞出现凋亡,HeLa 细胞则出现坏死,平均相移近乎指数下降;进一步增加照射剂量至 23mW/cm2,两种细胞的平均相移均下降,但 HeLa 细胞的下降开始得更早且更为明显。通过 AO/EB 和 Annexin V/PI 染色验证了细胞死亡途径的判断,表明 A549 细胞对 光敏剂Radachlorin 的光动力治疗比 HeLa 细胞更具抵抗力。
2 光敏剂的累积与定位
如图3所示,由a-d分别表示Hela细胞摄取光敏剂后时间为2 min,30 min,60 min和24 h的寿命成像图,结果显示随着时间增加,光敏剂Radachlorin 逐渐从细胞膜富集到细胞质再进一步富集到细胞核中周围,荧光寿命也逐渐缩短,由 5.5ns变为最终的 4ns 的区域。孵育 24 小时后,Radachlorin 主要定位于核周区域。
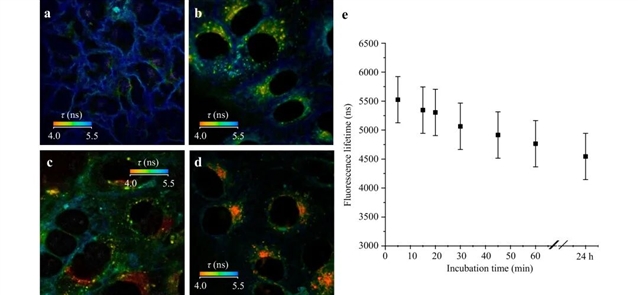
图3:光敏剂的定位追踪图
作者进一步使用溶酶体和线粒体进行荧光共定位实验,通过Merge图像清楚地显示了光敏剂主要与溶酶体共定位,而与线粒体的共定位不明显,说明它是通过内吞进入细胞,先去内体,再去溶酶体,在路上,它的“荧光寿命”越来越短,因为环境越来越酸。
FLIM 测量表明,Radachlorin 的荧光寿命随孵育时间逐渐下降,且与 溶酶体明显共定位,说明光敏剂主要经内吞作用进入细胞并在溶酶体富集。两种细胞系的摄取动力学相似,但 HeLa 细胞显示更高的细胞内累积浓度,这可能是其对光动力治疗抵抗力较低的原因之一。
3 细胞的代谢差异检测
内源性辅酶 NADH 和 FAD 参与哺乳动物细胞的糖酵解和氧化磷酸化两种代谢反应,其荧光衰减时间取决于分子是否与蛋白质结合:结合态 FAD 和游离态 NADH 的荧光衰减时间在数百皮秒范围内,而游离态 FAD 和结合态 NADH 的荧光衰减时间在纳秒范围内。
文中NADH/FAD 的双指数分析显示 A549 细胞具有较高的氧化磷酸化比例,而 HeLa 更偏向糖酵解代谢。该代谢差异与 PDT 后的细胞命运呈相关性:HeLa 在较低光照剂量即可诱导凋亡,而 A549 显示更高的耐受性。
总结与展望
本研究建立的 QPI–FLIM 多模态成像平台能够在无标记条件下同步追踪细胞形态变化、代谢动态及光敏剂摄取行为,为解析 PDT 诱导的细胞死亡机制提供了新的数据维度。系统的灵敏度与时空一致性使其适用于药物筛选、能量代谢研究及细胞损伤机制分析。未来,该平台有望扩展至三维活细胞成像、光遗传学刺激与深度学习辅助分析等方向,以进一步提升癌症治疗与诊断中的成像能力。(来源:先进制造微信公众号)
相关论文信息:https://doi.org/10.37188/lam.2025.079
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。