|
|
|
|
|
基于纳米硒佐剂的黏膜纳米疫苗助力急性烈性传染病防控 |
|
|
2025年10月15日,暨南大学化学与材料学院许利耕/陈填烽教授团队在Chem期刊上发表了一篇题为“Mucin-defined repulsion domain inspiring precise PEGylation shielding empowers selenium nanovaccines as universal mucosal ones against infections”的研究成果。
研究组开发的基于纳米硒佐剂的黏膜纳米疫苗可作为通用性递送系统用于急性烈性传染病的防控,具有极其重要的临床应用价值。论文通讯作者是许利耕教授、陈填烽教授,第一作者为硕士研究生雷思敏。
新型冠状病毒(SARS-CoV-2)、高致病性禽流感病毒感染等急性、烈性传染病严重危害人类健康,给国家带来了巨大经济损失。呼吸道黏膜、泌尿生殖系统黏膜、皮肤等黏膜组织作为人体重要的防御屏障,在保护机体免受病原体等侵袭中发挥关键作用。然而,这些黏膜组织既是病原体感染的主要靶标,也是疫苗递送过程中难以逾越的关键屏障,极大限制了疫苗的防护效果。因此,如何设计开发安全、强效的新型黏膜疫苗一直是该领域亟待解决的重大需求。
近年来,基于脂质纳米颗粒(LNP)等纳米佐剂材料的新型疫苗在重大疾病防治中展现出极大的应用前景。然而,较为复杂的合成方法与规模化制备瓶颈、安全性问题等依然是限制纳米疫苗快速转化应用的关键瓶颈。同时,特殊人群如婴幼儿、老年人和免疫缺陷人群等的免疫功能低下,以及病原体感染导致的免疫细胞功能障碍等,则是新型疫苗研发面临的另一重大挑战。
硒(Se)作为人体必需的微量元素,在维持机体正常生命活动包括免疫细胞功能与动态调控中发挥着极其关键的作用。前期一系列研究表明,基于纳米硒佐剂的纳米疫苗可诱导强效的天然免疫和细胞免疫反应,且可诱导大量长效、高效的特异性中和抗体产生(Signal Transduct Target Ther, 2023; Small Method, 2023)。
因此,针对上述难题,该团队通过解析黏液素(黏膜屏障的关键组分)的不同结构域,以卵清白蛋白(OVA)、猪繁殖与呼吸障碍综合征病毒(PRRSV)作为蛋白质抗原、灭活病毒抗原的典型代表,通过调控不同种类聚乙二醇分子(PEG200, PEG1500, PEG6000)、抗原、以及亚硒酸钠的相互作用,采用一步法快速合成了表面化学精准调控的纳米硒黏膜疫苗。发现PEG的分子量决定着纳米疫苗与黏膜屏障的相互作用,基于中分子量PEG分子的纳米硒疫苗可高效跨越呼吸道黏膜屏障,并通过调控免疫细胞氧化还原平衡改善免疫功能,从而提高巨噬细胞、NK细胞、IgA抗体等水平诱导强效的细胞免疫、体液免疫、以及黏膜免疫。同时,中分子量PEG分子的纳米硒疫苗能有效增强免疫记忆保护反应,显著诱导肺部中记忆细胞的产生,尤其是组织驻留记忆T/B细胞的生成,促进了黏膜免疫的快速应答,实现对病原体侵袭靶细胞的高效阻断。该研究构建的基于纳米硒佐剂的黏膜纳米疫苗,可作为通用型递送系统用于急性烈性传染病防控,具有极其重要的临床应用意义。
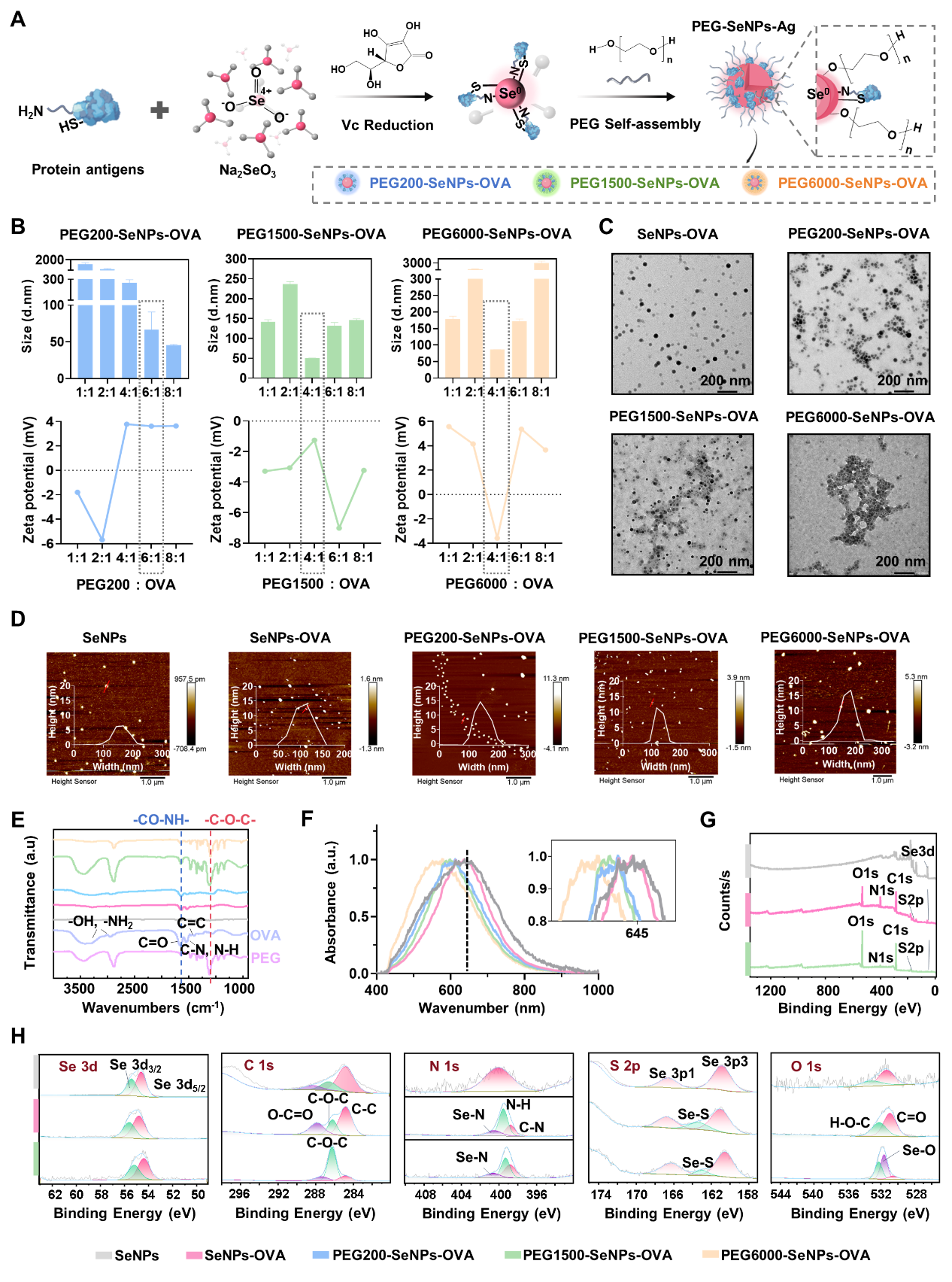
图1:聚乙二醇(PEG)精准修饰的纳米硒黏膜疫苗合成简便且展现出良好的稳定性。
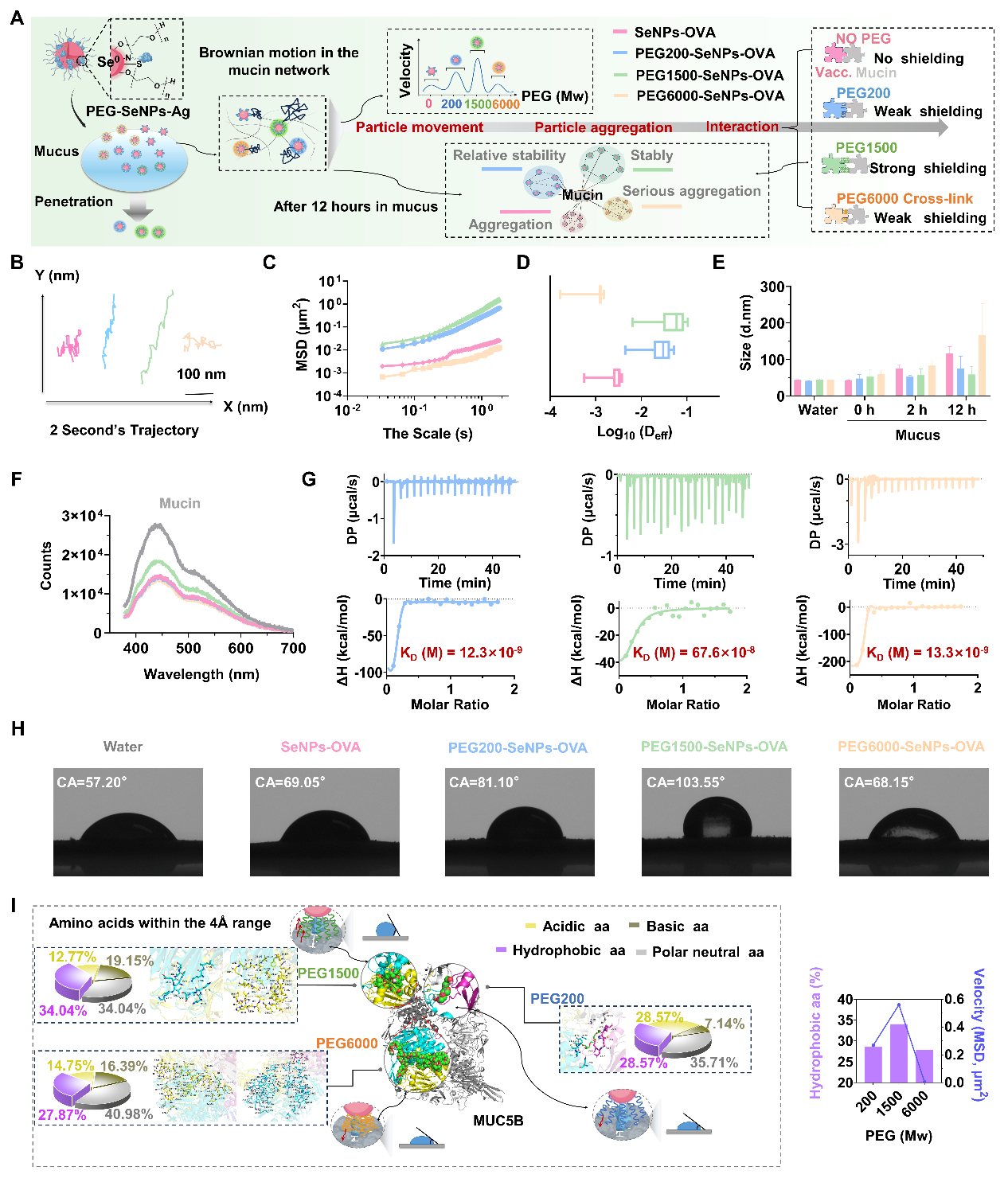
图2:通过调控疫苗与黏蛋白之间结合结构域的疏水性,聚乙二醇1500(PEG1500)修饰的纳米硒疫苗在人工黏蛋白溶液中展现出最高的扩散能力。
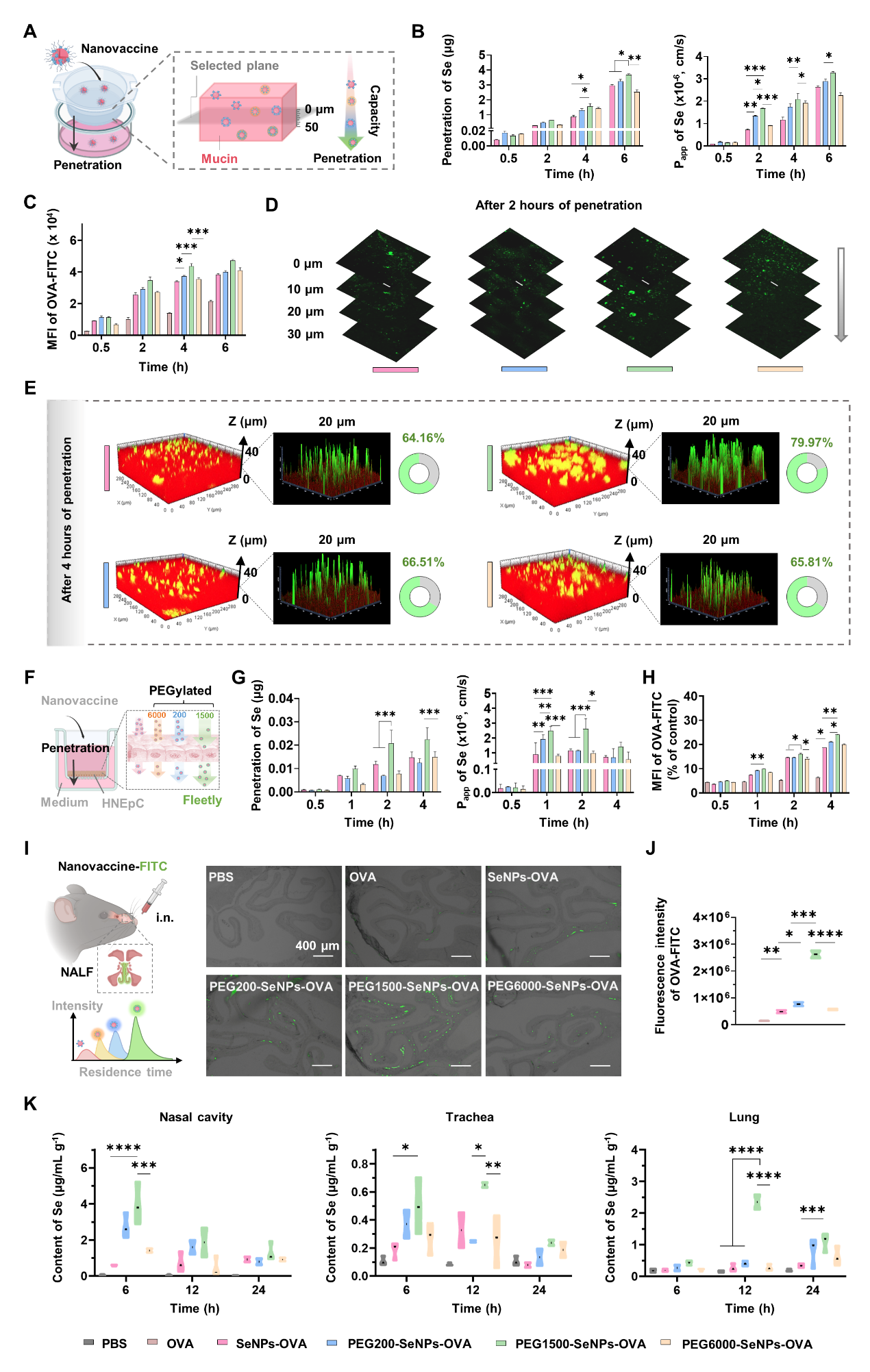
图3:聚乙二醇1500(PEG1500)修饰的纳米硒疫苗在体外和体内模型中均展现出最高的黏液穿透能力。
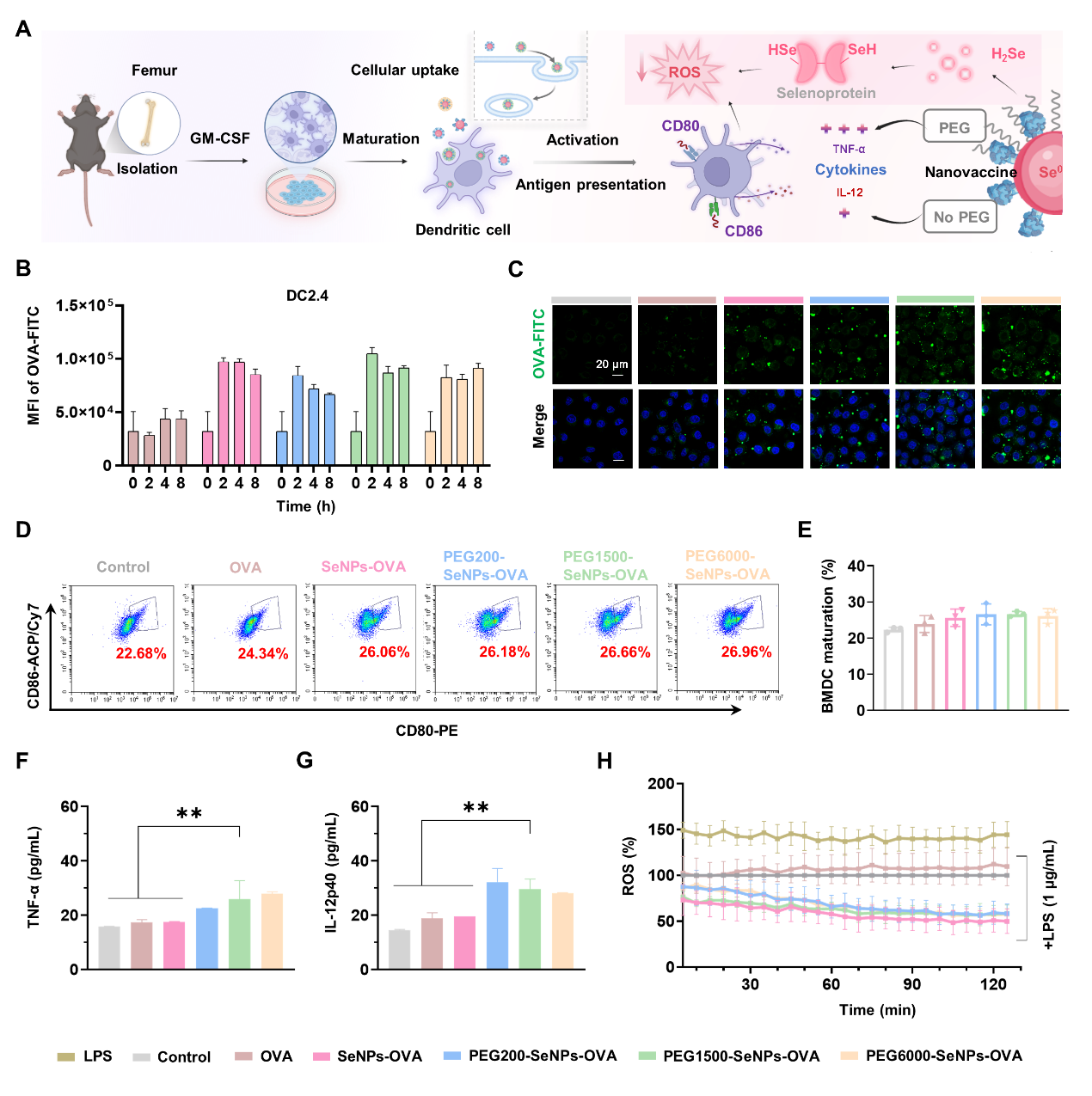
图4:聚乙二醇修饰不影响纳米硒黏膜疫苗的细胞摄取及对骨髓来源树突状细胞的激活作用,且可通过降低活性氧显著促进成熟相关细胞因子的表达分泌。
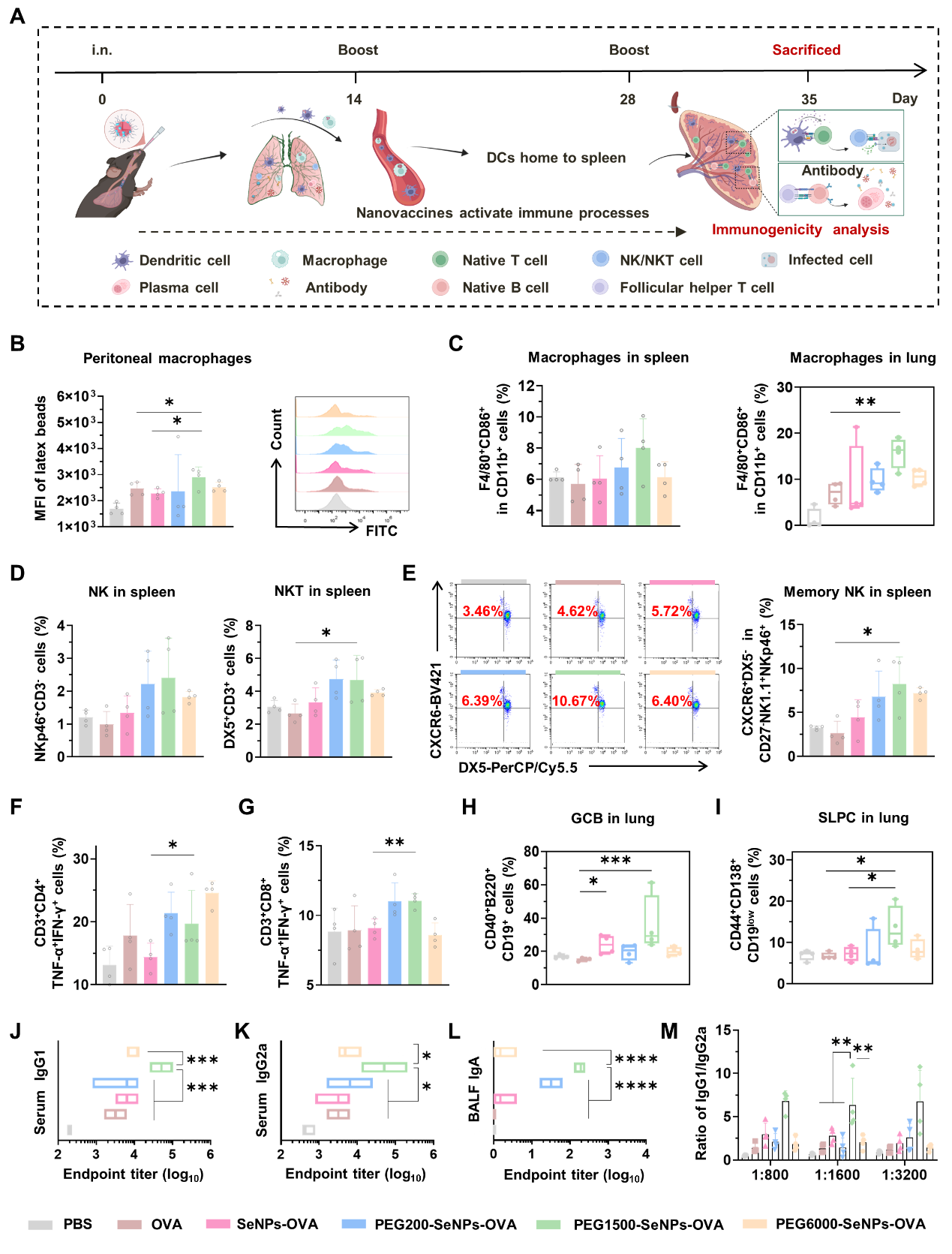
图5:聚乙二醇1500(PEG1500)修饰的纳米硒黏膜疫苗具有最强的免疫原性,可高效激活天然免疫、适应性免疫(细胞免疫与体液免疫)及黏膜免疫反应。
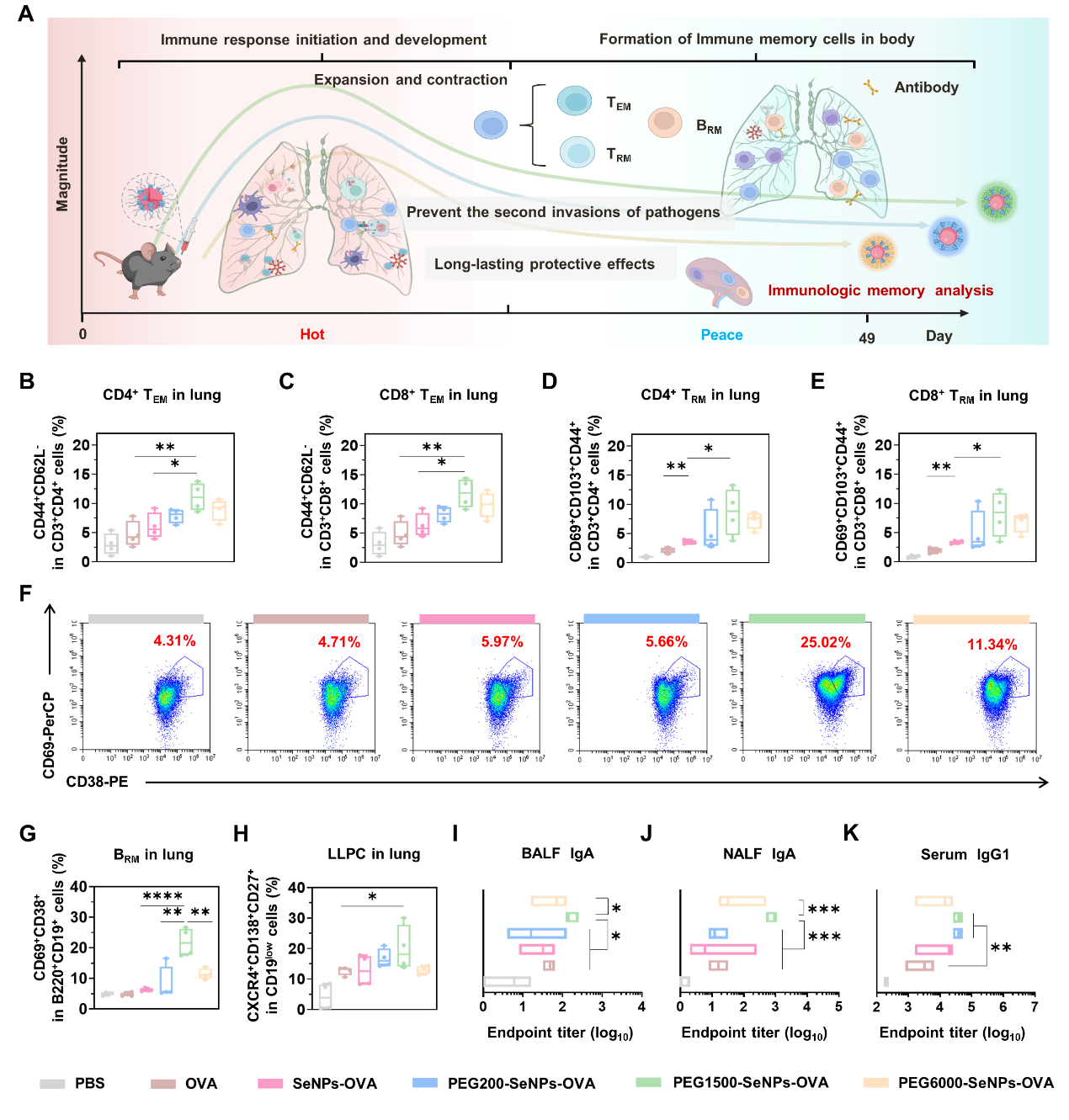
图6:聚乙二醇1500(PEG1500)修饰的纳米硒黏膜疫苗在诱导强效免疫记忆尤其黏膜组织驻留免疫记忆应答方面展现出最高活性。
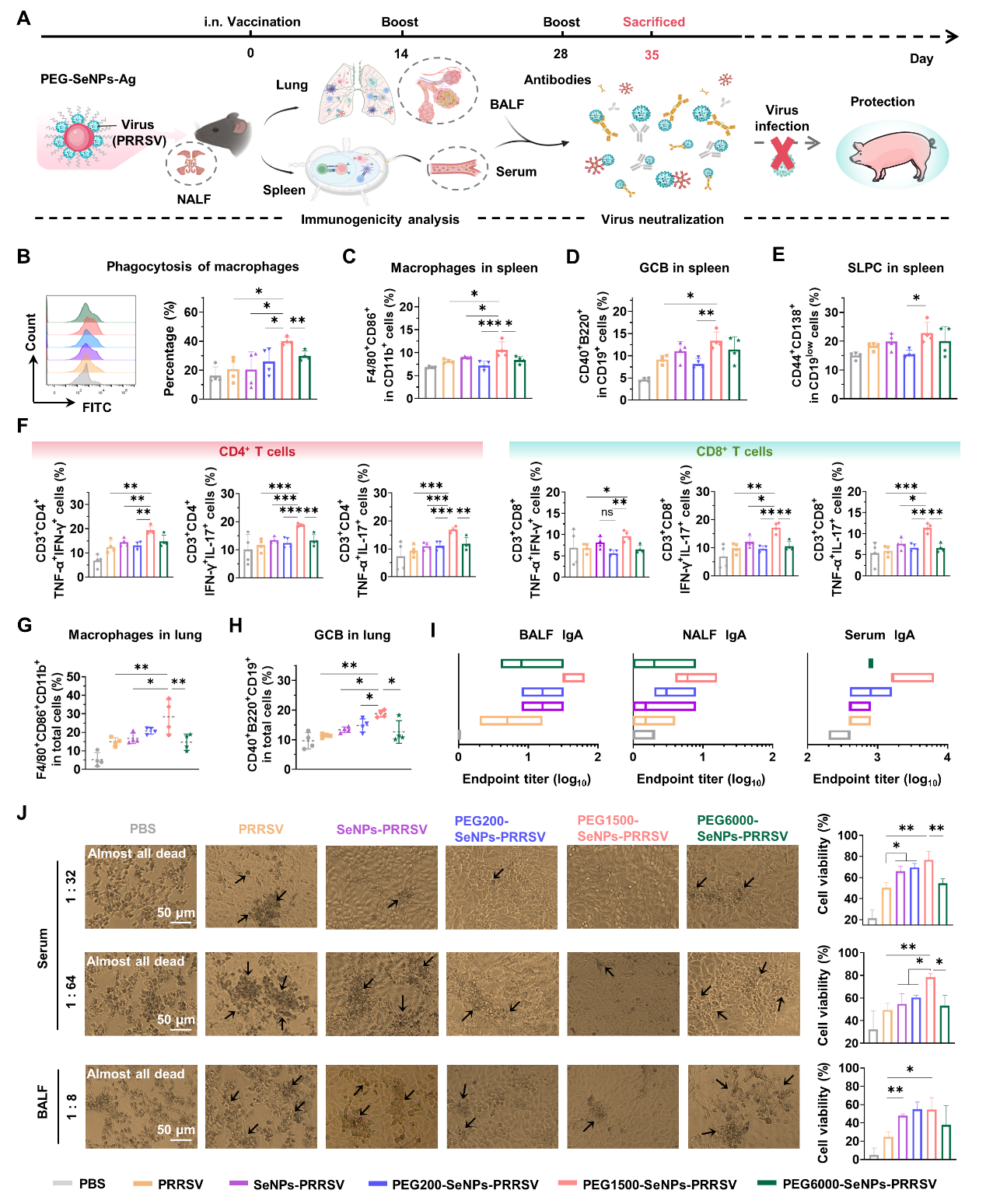
图7:聚乙二醇精准修饰的纳米硒猪繁殖与呼吸综合征病毒(PRRSV)灭活疫苗展现出良好的免疫原性,可诱导强效黏膜免疫应答,阻断病毒对猪的感染。
该工作得到了国家自然科学基金杰出青年基金、国家自然科学基金面上项目、广东省自然科学杰出青年基金和暨南大学等项目的资助。(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.chempr.2025.102776