华东师范大学教授翁杰敏团队与中国科学院分子细胞科学卓越创新中心(生物化学与细胞生物学研究所)研究员陈德桂团队合作,揭示了哺乳动物细胞近着丝粒异染色质形成、维持和稳定遗传的新机制,对异染色质调控机制有了新认知,为理解多种疾病的发生机制提供了新视角。相关研究10月15日发表于《自然》。
真核生物的基因组由高度浓缩的异染色质和结构松散的常染色质组成。其中,近着丝粒异染色质是染色质三维结构的重要组成部分,在着丝粒形成、姐妹染色体分离、基因组稳定性维持等方面发挥着关键作用,被认为是染色质稳态遗传的“记忆中枢”。已有研究证实,组蛋白H3第9位赖氨酸的三甲基化修饰(H3K9me3)是异染色质形成和维持的关键标志,但该修饰在细胞分裂过程中被精确“传承”的机制尚不清晰。
研究团队利用高通量筛选技术,发现了一个在细胞周期G2/M期特异性高表达的泛素连接酶G2E3。在近着丝粒区域,G2E3能够特异性催化组蛋白H3第14位赖氨酸的单泛素化修饰(H3K14ub),进而调控异染色质的稳态遗传。
机制研究表明,G2E3扮演“先锋因子”的角色,在有丝分裂早期即定位到近着丝粒区域,通过催化H3K14ub“标记”招募组蛋白甲基化酶SUV39H1/2,进而促进H3K9me3修饰的建立和异染色质结合蛋白HP1的招募,形成完整的调控环路,确保异染色质结构在细胞分裂过程中的准确传承。值得一提的是,G2E3缺失不仅损害了近着丝粒异染色质的结构,还导致SUV39H1/2和H3K9me3在常染色质区域的异常积累,引发广泛的转录抑制,表明G2E3是基因组染色质区室化的关键调控者之一。
研究团队同时发现,尽管酵母和哺乳动物使用了完全不同的泛素连接酶,但均通过H3K14ub依赖的H3K9甲基化酶的招募与激活实现异染色质的形成与维持及在有丝分裂过程中的稳态传递,同时调控整个基因组染色质的区室化,体现了生命演化过程中的“殊途同归”。
翁杰敏介绍,团队正在进一步研究G2E3在肿瘤发生和发展中的具体作用机制,以期为相关疾病的诊断和治疗提供新策略。(来源:中国科学报 江庆龄)
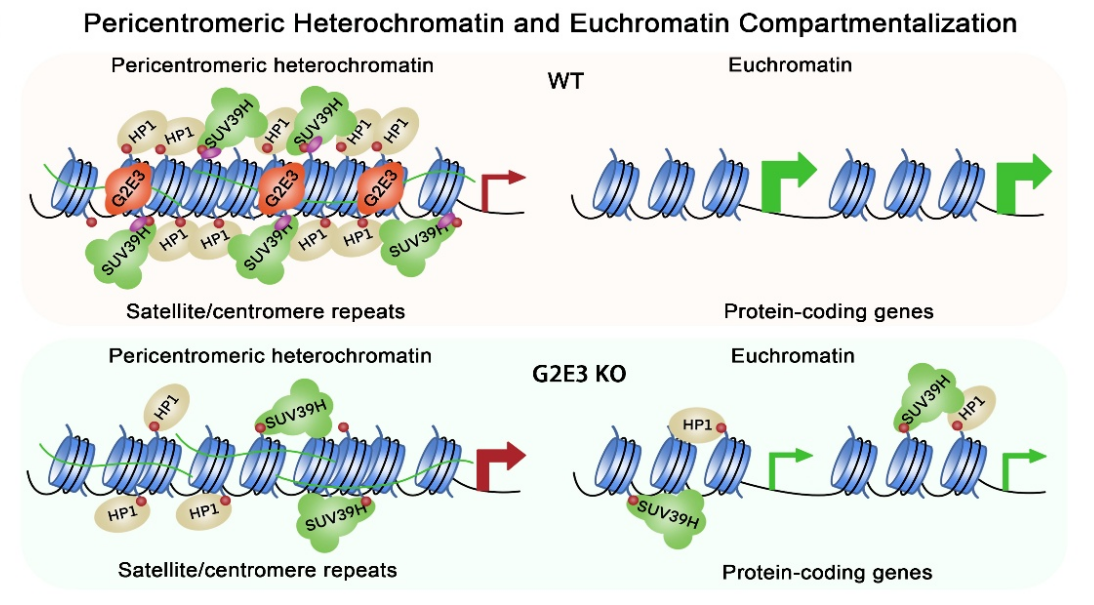 近着丝粒异染色质和常染色质区室化的工作模型。图片由研究团队提供
近着丝粒异染色质和常染色质区室化的工作模型。图片由研究团队提供
?
相关论文信息:https://doi.org/10.1038/s41586-025-09624-5