2022年5月19日,南开大学化学学院余志林团队在在J. Am. Chem. Soc.上发表了一篇题为“In Situ Self-Sorting Peptide Assemblies in Living Cells for Simultaneous Organelle-Targeting”的新研究。
论文首次报道了细胞内自分类组装体系构筑策略,实现对不同生物过程的协同调控,为开展原位生物活性材料提供了一种全新的策略。论文通讯作者为余志林,第一作者是刘欣和李明明。
自分类组装是指不同组装基元通过选择性非共价相互作用,构筑由特定基元组分形成有序结构的过程,是生命体系中构建复杂而有序生物结构最为常见的方式。例如细胞骨架中的微管和微丝分别是由机动蛋白和微管蛋白通过自我识别而聚集形成的纤维结构。多肽分子具有与蛋白质相同的组成成份,其在细胞内通过原位组装构筑有序纳米结构是开发生物医用功能材料的有效手段,在疾病诊断与药物递送中具有广泛的应用前景。受蛋白质自分类组装现象的启发,在胞内原位构筑多肽自分类组装体系对于实现不同生物过程的协同调控意义重大。然而,受限于多肽骨架的结构相似性(肽键),建立不同多肽基元的选择性相互作用极具挑战,因此胞内多肽自分类组装至今尚无报道。
近日,南开大学余志林团队提出了一种基于不同组装模式下的谷胱甘肽(GSH)刺激响应多肽原位自分类组装体系,具有同时靶向细胞器内质网和高尔基体的功能,通过协同调控细胞器功能障碍,实现肿瘤细胞的有效杀伤。
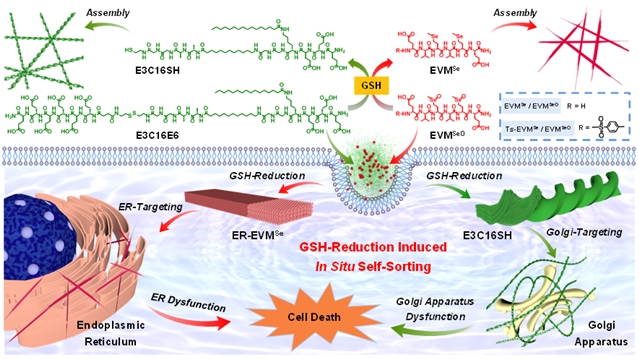
图1:胞内多肽原位自分类组装过程示意图。图片来源:J. Am. Chem. Soc.
在前期构建多肽可控组装策略及生物医用功能材料的工作基础之上(J. Am. Chem. Soc. 2022, 144, 6907;J. Am. Chem. Soc. 2021, 143, 13854;Nano Lett. 2021, 21, 5730;Nano Today 2021, 38, 101198;Chem. Sci. 2020, 11, 1383;Nano Lett. 2019, 19, 7965;J. Am. Chem. Soc. 2017, 139, 7823),余志林团队设计合成了两种多肽基元E3C16E6和EVMSeO。其中,E3C16E6分子在GSH还原二硫键的条件下形成E3C16SH分子,进一步通过类似磷脂分子双分子层堆积模式穿插组装形成超螺旋纤维,而EVMSeO在GSH还原形成含硒醚的哑铃型两亲性多肽基元,组装形成纳米带结构。这两种多肽组装基元尤其是堆积模式的差异,有望实现GSH响应的原位自分类组装过程。多肽基元E3C16与EVMSe的自组装行为通过原子力显微镜(AFM)和透射电子显微镜(TEM)实验得到了充分的验证。而利用结构光照明共聚焦显微镜(SIM),作者直接观察到了不同荧光分子标记多肽纳米结构的独立形成。
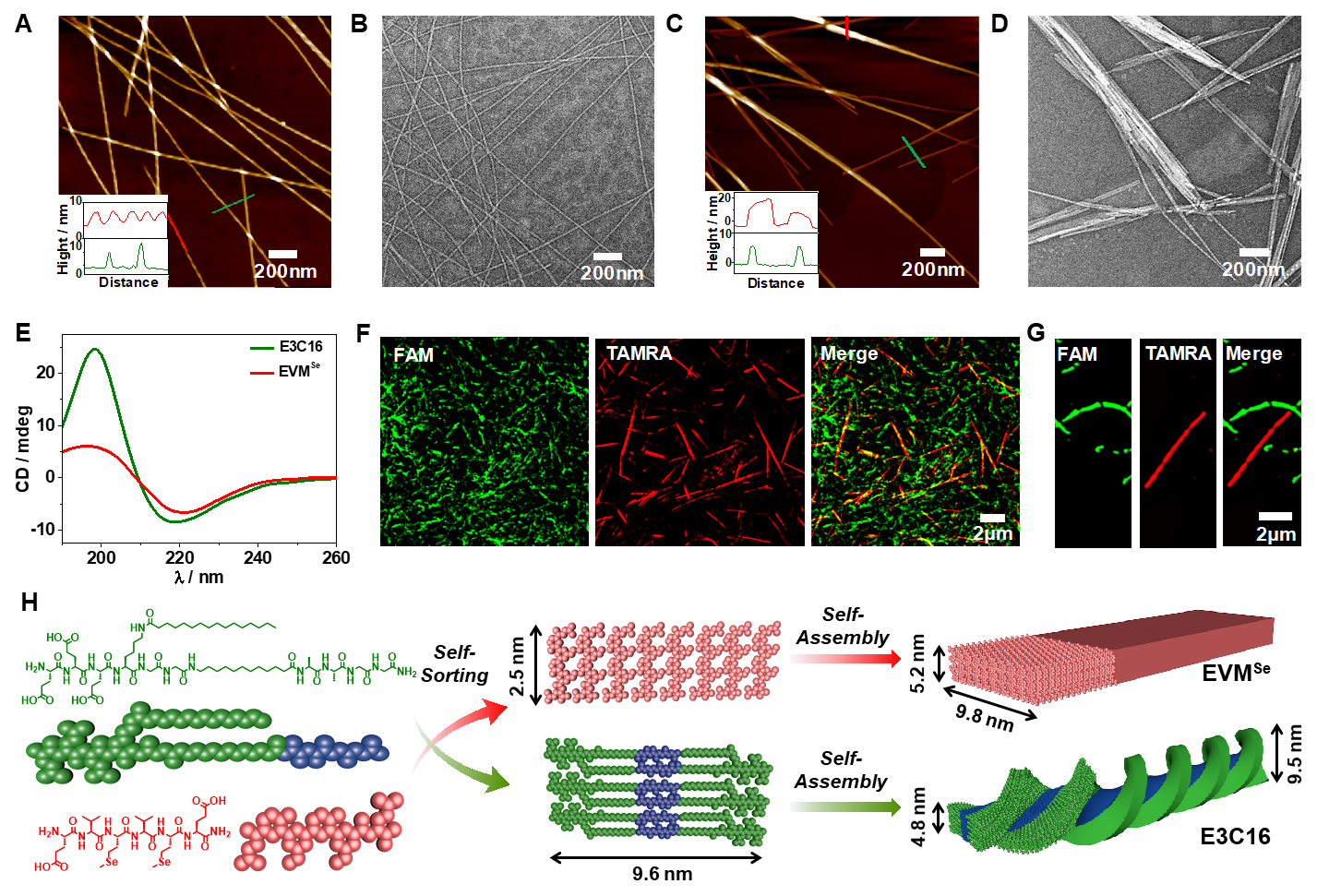
图2:多肽自组装及自分类组装表征及自分类组装机制示意图。图片来源:J. Am. Chem. Soc.
E3C16SH形成的多肽纳米纤维含有巯基基团,可以与高尔基体上富含硫醇蛋白通过形成二硫键,进而具有靶向高尔基体的性质。而在EVMSe还原后组装体中引入内质网靶向肽Ts-EVMSe,共组装得到具有内质网靶向功能的共组装体ER-EVMSe。具有GSH响应E3C16E6和ER-EVMSeO基元在溶液中和细胞内自分类组装过程通过超分辨荧光显微镜SIM实验得到了验证。实验结果表明,该两种多肽基元能够独立形成不同荧光标记的纳米结构。而激光共聚焦实验证明了不同多肽纳米结构对高尔基体和内质网的靶向作用。

图3:溶液中和细胞内GSH响应多肽原位自分类组装。图片来源:J. Am. Chem. Soc.
最后,作者通过细胞毒性实验、蛋白免疫印迹和蛋白免疫荧光实验,证实了多肽原位自分类组装体系通过对高尔基体及内质网的双重靶向,协同调控细胞器功能障碍,最终达到有效杀伤肿瘤细胞的效果。该体系的成功构建为多肽功能化体系对细胞内结构和信号通路调节提供了新策略,为疾病诊断与药物靶向递送提供了新思路。(来源:科学网)
相关论文信息:https://doi.org/10.1021/jacs.2c01025