临港实验室研究员蒋轶,中国科学院上海药物研究所研究员徐华强、杨德华等,鉴定了去甲肾上腺素转运体(NET)内向开放构象特异性的变构位点,提出了靶向该构象的阻断剂识别新机制“瓣膜模型”,并发现了具有体内外抗抑郁活性的小分子,为理解NET及其他单胺类转运体的配体调控机制奠定了重要的结构基础,也为开发靶向单胺转运体的抗抑郁等神经精神疾病药物提供了新思路。相关研究10月24日发表于《细胞》。
NET是单胺转运体家族的重要成员,负责再摄取大脑突触间隙的去甲肾上腺素和多巴胺,与血清素转运体及多巴胺转运体共同维持突触单胺类神经递质的稳态。NET在调节情绪、注意力及应激反应中发挥关键作用,是治疗重度抑郁症和注意缺陷多动障碍等神经精神疾病的重要药物靶点。然而,NET如何被不同药物精准调控,尤其是其构象选择性与变构调控机制,仍有待深入阐明。
研究团队解析了人源NET分别与抗抑郁药物左米那普仑、维拉佐酮,以及NET与多巴胺转运体双重再摄取抑制剂伐诺司林结合的三个冷冻电镜结构。三种复合物中NET均呈现内向开放构象。其中,左米那普仑结合于一个NET内向开放构象特异的新型变构位点。该位点被命名为S3,区别于中央正构位点S1和位于靠近胞外区的外向开放构象变构位点S2。与之不同的是,维拉佐酮和伐诺司林同时占据S1与S3位点。
进一步,研究团队提出了NET抑制剂识别的“瓣膜模型”,即NET内向开放空腔中的两个关键苯丙氨酸残基如同“心脏瓣膜”,其侧链相对排列,且侧链构象随不同抑制剂的结合而发生改变。这两个残基将内向开放空腔分隔为内室与外室两个非对称区域,不同化学结构的抑制剂被“瓣膜”引导结合至不同区域,如左米那普仑、维拉佐酮和伐诺司林结合于外室,而齐拉西酮则结合于内室。
基于“瓣膜模型”,研究团队对包含超过52万种小分子的化合物库进行了针对NET内向开放构象的虚拟筛选和验证,最终获得活性化合物F3288-0031。该化合物在体外表现出强效的NET抑制活性,并在小鼠强迫游泳实验中显示出明确的抗抑郁样效果,且未影响自发活动。药代动力学与脱靶效应研究表明,F3288-0031能够有效入脑,主要通过抑制NET和血清素转运体发挥治疗作用,且与其他关键神经靶点的交叉反应性较低,显示出良好的成药性与安全性。
研究团队表示,研究中构建的“结构解析–计算筛选–功能验证–结构验证”的多学科闭环研究策略,成功将靶标机制的基础研究成果转化为具有明确药理潜力的活性分子,为抗神经精神疾病创新药物的研发提供了新范例。
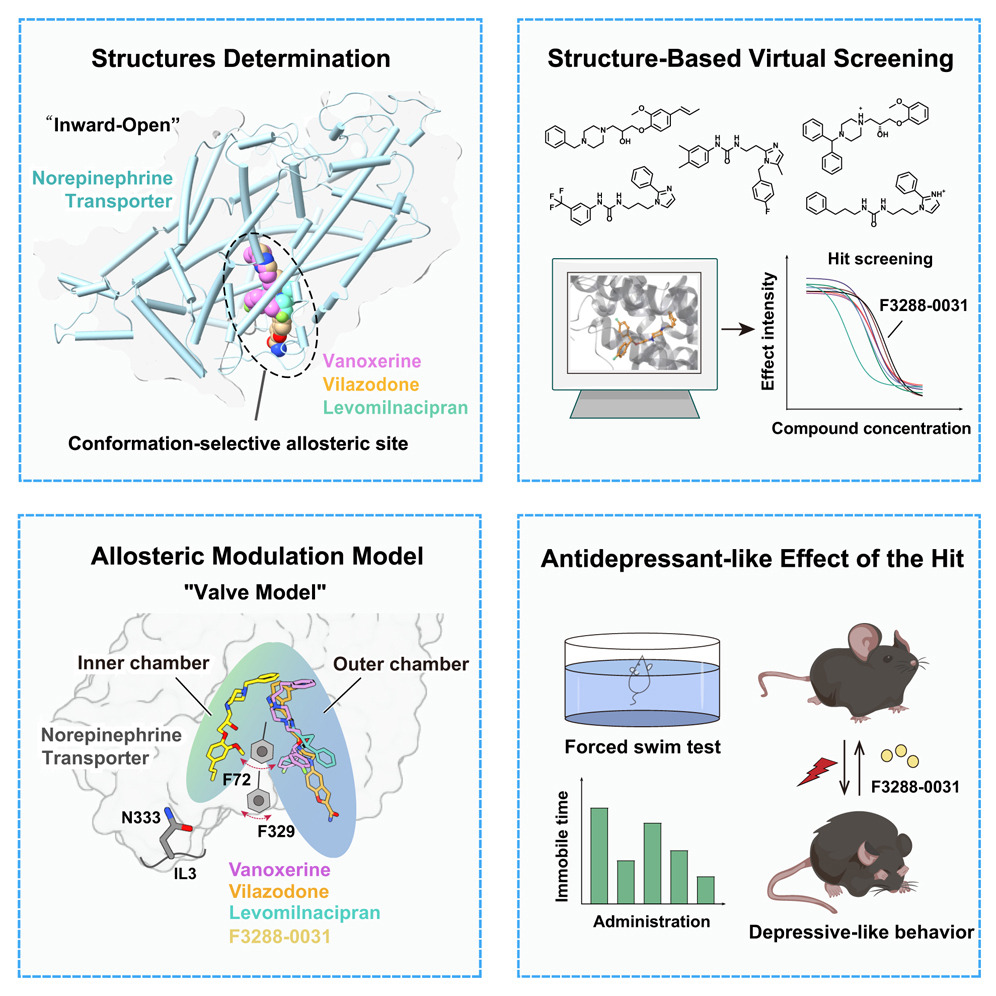 基于结构的NET构象选择性变构抑制剂发现。图片由研究团队提供
基于结构的NET构象选择性变构抑制剂发现。图片由研究团队提供
?
相关论文信息:https://doi.org/10.1016/j.cell.2025.10.002
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。