中国科学院上海药物研究所研究员徐华强团队、上海交通大学医学院附属仁济医院教授马雄团队合作,在原子水平上阐明了有机溶质转运蛋白Ostα/β独特的结构基础与工作机制,补全了肝肠循环及胆汁酸全身稳态调控中一块长期缺失的关键拼图,也为干预胆汁酸相关代谢性疾病提供了潜在的新靶点与思路。1月29日,相关研究成果发表于《自然》。
胆汁酸在机体的消化吸收、能量代谢与激素信号稳态中扮演着核心角色,在肝脏与肠道之间循环往返,构成精密的肝肠循环,并依赖一系列膜转运体协同完成。在肝脏中,胆汁酸的转运遵循经典模式,但其从肠上皮细胞基底外侧膜被有效输出至门静脉循环的分子机制长期未被解决,被认为是胆汁酸转运研究中的“西北航道”。已有研究证实,Ostα/β是肠上皮基底侧胆汁酸外排的关键执行者,该蛋白是由Ostα与Ostβ亚基组成的异源二聚体,其工作机制尚未被阐明。
研究团队在哺乳动物细胞中表达并纯化了人源Ostα/β复合物,利用单颗粒冷冻电镜技术获得了分辨率达2.6–3.1 ?的结构。Ostα/β以对称的四聚体形式组装,即由两个Ostα–Ostβ异源二聚体构成。其中,Ostα亚基呈现出全新的七次跨膜螺旋折叠方式,Ostβ亚基则贡献了一条跨膜螺旋,与Ostα的第七个跨膜螺旋紧密相邻,共同稳定了蛋白的核心架构。
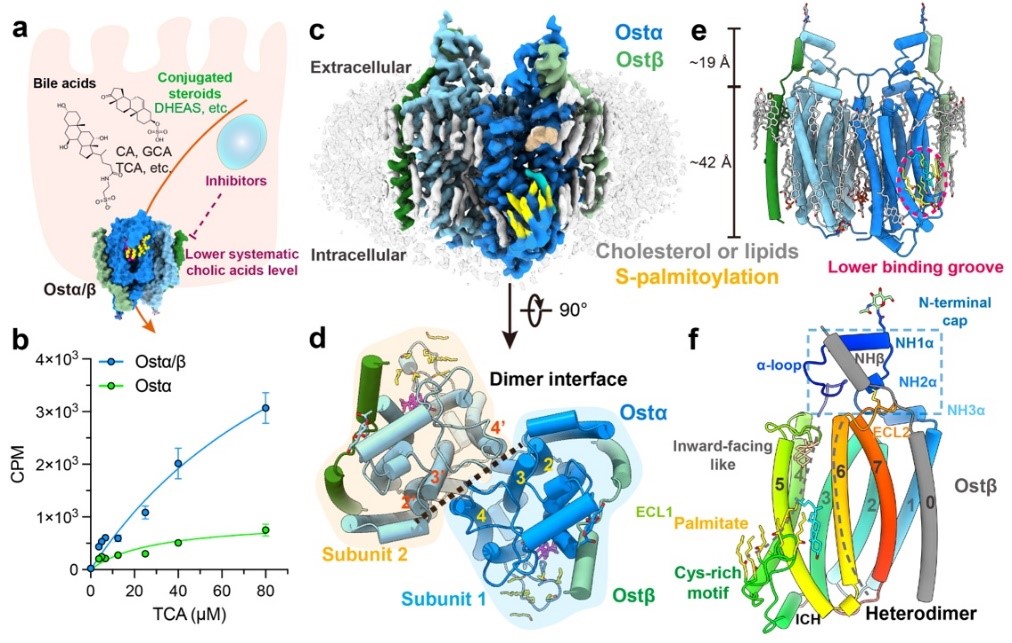 人源Ostα/β四聚体装配与整体结构示意图。研究团队供图
人源Ostα/β四聚体装配与整体结构示意图。研究团队供图
在靠近细胞质侧的膜内部,则存在一个侧向开放、适合两亲性固醇分子结合的底物结合沟槽。进一步地,研究团队分别解析了Ostα/β与牛磺石胆酸和脱氢表雄酮硫酸酯结合的高分辨率复合物结构。结果显示,沟槽内带正电荷的精氨酸残基与底物分子上的磺酸基团形成特异的静电相互作用,从而决定了Ostα/β对这类带负电荷底物的选择性。
此外,研究人员识别出一条从底部结合沟槽延伸至细胞外侧的亲水性通道,并预测底物可能经由这条通道进行跨膜移位。
为了动态验证这一转运过程,研究团队首次利用胆汁酸衍生物自身带电荷的特性,通过全细胞膜片钳技术,在表达Ostα/β的细胞中直接记录到了由底物应用所引发的、膜电位依赖性的跨膜电流。由此,实现了对胆汁酸转运过程的实时、且方向可控的监测。结果显示,Ostα/β作为一个易化扩散载体,其转运方向并非固定不变,而是由底物在膜两侧的电化学梯度共同决定。膜电位并非被动背景参数,而是偏置双向转运方向的关键决定因素,使Ostα/β在不同生理条件下更利于实现胆汁酸外排。
通过结构比对分析,研究团队发现,Ostα/β与功能尚未完全明确的TMEM184蛋白家族在拓扑结构上具有显著相似性。这提示,TMEM184家族成员可能同属一类新型的转运蛋白,为解析众多功能未知的“孤儿”膜蛋白开辟了新的研究方向。(来源:中国科学报 江庆龄)
相关论文信息:http://doi.org/10.1038/s41586-025-10029-7