|
|
|
|
|
Life Med | 陈磊等揭示肠道类器官在疾病模拟与治疗研发中的关键进展 |
|
|
论文标题:Advances and applications of gut organoids: modeling intestinal diseases and therapeutic development
期刊:Life Medicine
作者:Xiaoting Xu, Yuping Zhang, Guoxin Huang, Ansu Perekatt, Yan Wang, Lei Chen
发表时间:26 Sept 2025
DOI:10.1093/lifemedi/lnaf012
微信链接:点击此处阅读微信文章
肠道是人体的重要消化器官,承担着营养吸收、病原防御、内分泌调节及免疫稳态维持等多重功能。肠上皮组织通常在3-5天即可完成一次更新,这种高效的再生能力主要依赖于分布在肠隐窝底部的肠道干细胞。肠道干细胞的自我更新和多向分化能力使得体外构建类器官模拟肠道功能的研究提供了可能。传统的二维细胞培养体系,因缺乏组织结构、细胞异质性和微环境信号,而无法真实反映肠道生理病理过程;动物模型则受限于种属、遗传及个体差异等,其研究结果外延至人体也存在明显的局限性。基于肠道干细胞的特性,通过体外三维培养,能构建出具有隐窝-绒毛样结构、包含多种细胞类型、并部分模拟肠道功能的“微型器官”。该技术的运用,能够打破传统研究体系的限制,为肠道领域的研究带来系统性的革新。

近日,东南大学生命科学与技术学院陈磊教授团队在Life Medicine发表了题为“Advances and applications of gut organoids: modeling intestinal diseases and therapeutic development”的综述论文,该文章的第一作者为生科院博士研究生徐小婷、张雨萍以及汕头市中心医院黄国鑫博士。文章系统回顾总结了肠道类器官的来源与培养技术,并对类器官在模拟肠道微环境和疾病模型中的应用进行了深入的阐述,同时也对类器官在药物筛选和类器官移植在个性化治疗方面的运用展开了前瞻性的探讨,为肠道类器官技术在生物学与医学等多领域的深入研究提供了基础支撑。
一、肠道类器官的培养
肠道类器官培养技术由Hans Clevers团队开创,并在近十来年取得重大进展。类器官主要源自成体干细胞(ASCs)和多能干细胞(PSCs)。ASCs类器官取自肠道组织,保留供体遗传特性,培养周期较短(约1-2周),稳定性高,适用于个体化医学。PSCs类器官(包括ESCs和iPSCs)则需更长时间分化(约3-4周),但能无限扩增,更好模拟肠道早期发育,是发育生物学研究的理想模型。目前,PSCs类器官培养仍依赖Matrigel,但其成分复杂、批次差异大,影响实验可重复性。近年来,基于组织工程学合成的水凝胶(如PEG基)体系为解决该问题提供了新思路。通过调控水凝胶硬度、降解性及功能修饰(如RGD肽),可定向调控干细胞行为。同时,培养基的优化也取得突破,由Wnt激动剂(R-spondin1)、表皮生长因子(EGF)和BMP抑制剂(Noggin)等核心组分构成的培养基,能够模拟肠道隐窝底部干细胞微环境的关键信号特征。在人源类器官添加TGF-β和p38 MAPK抑制剂能够提高其存活率。此外,不同肠道区段(如小肠与结肠)类器官需调整生长因子比例(如烟酰胺和Wnt3a等),反映肠道微环境异质性对类器官形成的影响。
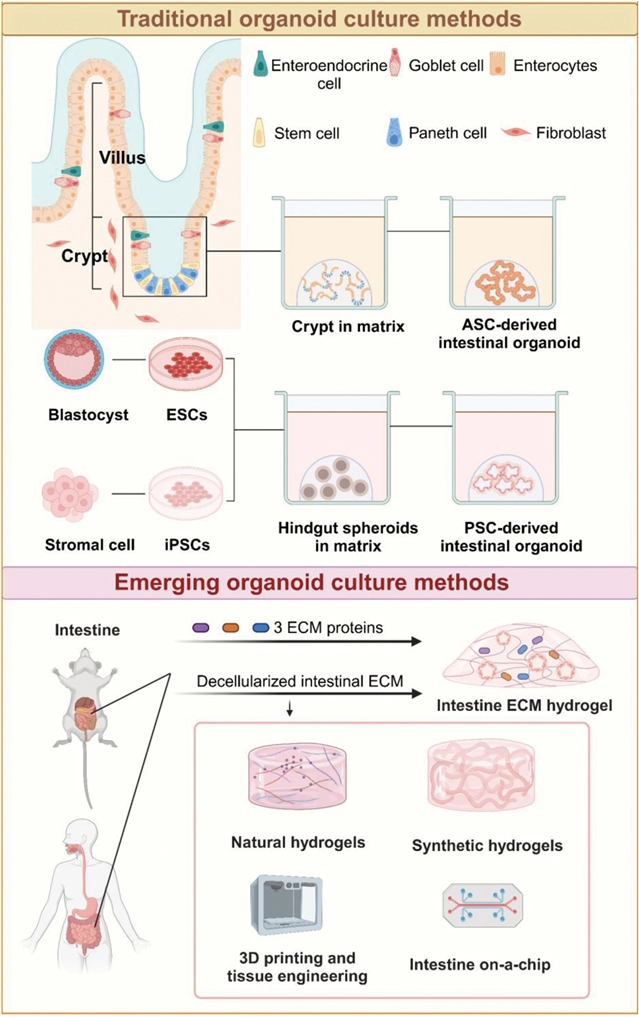
图1:肠道类器官培养方法
二、肠道类器官及其微环境
近年来,肠道类器官技术在模拟体内肠上皮与肠道微环境间复杂联系的研究方面取得重要突破。通过整合肿瘤微环境-类器官体系,研究发现肿瘤相关成纤维细胞(CAFs)能通过分泌TGF-β、HGF等因子促进肿瘤侵袭与转移,并诱导上皮-间质转化,同时类器官共培养系统也有效解析了CAFs亚型(如iCAFs和myCAFs)的功能差异。在免疫微环境-类器官共培养体系中,成功模拟了炎症性肠病的病理过程,为疾病机制研究和生物制剂评估提供了新平台。例如,在炎症性肠病(IBD)研究中,将患者来源的类器官与自体免疫细胞共培养,再现了体内免疫细胞攻击上皮细胞的过程。该模型不仅有助于阐明疾病机制,还可用于检测新型生物制剂(如抗TNF-α抗体)的治疗效果。最新的进展还包括建立类器官-免疫细胞相互作用的动态监测系统,通过活细胞成像技术实时观察免疫细胞与上皮细胞的相互作用过程。而在肠神经系统研究方面,神经嵴干细胞与类器官共培养构建了具有功能性神经支配的模型,为研究肠-脑轴调控机制及肠道动力障碍疾病创造了条件。
此外,器官芯片技术的引入,进一步扩大与深化了类器官技术的研究领域。通过微流控器官芯片可以实现类器官血管化,构建的灌注式培养系统能够延长类器官的培养时间至1个月以上,显著提升了类器官-药物代谢研究的可靠性;而极性反转技术(即通过改变细胞极性,使得细胞的顶端朝向培养基外侧,而底端朝向类器官的基底)则突破了厌氧菌共培养限制,使类器官能与拟杆菌等肠道菌群长期互作,为微生物组研究提供了新工具。这些进展使肠道类器官在肿瘤学、免疫学、神经科学和微生物组研究等领域展现出独特价值,为精准医学研究提供了更接近体内环境的模型体系。
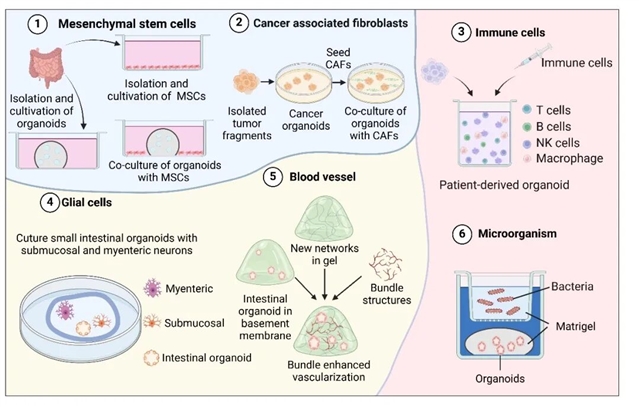
图2:使用肠道类器官模拟肠道微环境
三、肠道类器官模拟疾病模型
患者来源的类器官(PDOs)在疾病建模方面展现出显著优势,近年来取得多项重要突破。在结直肠癌研究中,PDOs能高度保留原发肿瘤的组织学特征、基因突变谱和细胞异质性,基因组测序显示其与原发肿瘤的突变一致性超过90%,使其成为研究肿瘤异质性的理想模型。PDOs药敏试验结果与临床疗效高度吻合,一项纳入55例转移性结直肠癌患者的研究显示,PDOs预测化疗敏感性和耐药性的准确率分别达88%和100%,为个体化治疗提供重要依据。在炎症性肠病研究中,通过CRISPR-Cas9在健康类器官中引入NOD2、ATG16L1等IBD相关突变,最新研究还整合患者免疫细胞构建了更加完整的IBD模型,并用于检测免疫调节剂疗效。而在囊性纤维化(CF)研究中,通过Forskolin诱导直肠类器官肿胀实验,即将类器官暴露于化学物质后,类器官液体分泌或吸收变化,导致类器官肿胀或缩小。通过观察肿胀反应,评估CFTR突变对氯离子通道功能的影响,并通过结合基因型分析进而显著提升诊断准确性。该模型也用于测试CFTR调节剂(如ivacaftor)疗效,多中心研究显示其预测准确率达96%。此外,有关类器官在乳糜泻中的研究也取得进展,研究人员通过整合HLA-DQ2/DQ8和免疫细胞的类器官模型成功模拟麸质肽诱导的免疫反应,为开发酶解麸质和表位特异性免疫疗法奠定基础。这些突破使PDOs成为个体化精准医学研究的重要工具。
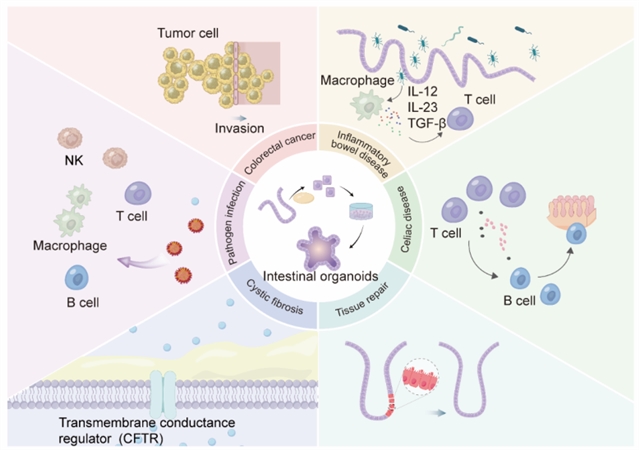
图3:使用肠道类器官模拟肠道疾病
四、药物开发与再生医学应用
在药物开发领域,肠道类器官技术正在推动从传统筛选模式向更精准、高效的方向转变。高通量筛选平台与类器官技术的结合大大提升了药物发现效率。最新的自动化系统可以在384孔板中同时培养和处理上千个类器官,结合高内涵成像技术,实现多参数的药效评估。这种高通量平台特别适合筛选针对肠道疾病的候选药物,如IBD治疗药物和肠道抗感染药物。与此同时,器官芯片技术的创新应用进一步拓展了类器官技术的应用范围,使研究人员能够在动态条件下评估药物的吸收、分布、代谢和排泄特性。通过整合肠道类器官和肝脏类器官的微流控系统,还可以模拟药物的首过代谢过程,更准确地预测药物的生物利用度。这类系统还能研究药物引起的肠道毒性,如非甾体抗炎药导致的肠黏膜损伤。
在再生医学方面,类器官移植为短肠综合征等疾病的治疗带来了新希望。动物实验证实,移植的肠道类器官能够与宿主组织整合,形成具有功能的肠黏膜。最新的进展包括使用生物可降解支架作为类器官载体,提高移植效率;以及开发内镜下微创移植技术,减少手术创伤等。特别值得一提的是"小肠化"改造策略,通过将回肠类器官移植到结肠部位,成功改善了短肠综合征动物的营养吸收功能,这一创新为临床转化奠定了基础。
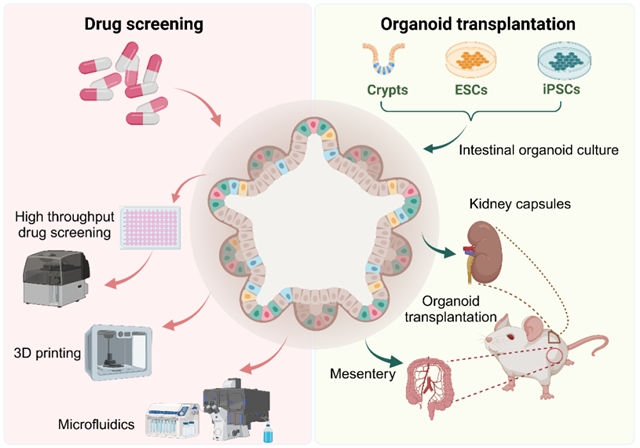
图4:药物筛选和类器官移植
五、技术挑战与未来展望
肠道类器官技术为肠道发育、疾病机制研究和药物开发提供了生理相关的体外模型,已广泛应用于结直肠癌、炎症性肠病和囊性纤维化等疾病的建模。然而,现有模型缺乏血管、神经和免疫系统,限制了其模拟复杂微环境的能力,其培养标准化和重复性也有待改进。未来研究应聚焦多细胞整合模型、器官芯片、3D生物打印和疾病特异性类器官的构建,这将有助于推动个性化治疗和再生医学的应用。
英文全文链接:
https://doi.org/10.1093/lifemedi/lnaf012
引用本文:
Xiaoting Xu, Yuping Zhang, Guoxin Huang, Ansu Perekatt, Yan Wang, Lei Chen, Advances and applications of gut organoids: modeling intestinal diseases and therapeutic development, Life Medicine, Volume 4, Issue 2, April 2025, lnaf012, https://doi.org/10.1093/lifemedi/lnaf012
作者简介

陈磊
东南大学
陈磊,东南大学青年首席教授、博士生导师、副院长,国家级高层次人才、国家重点研发计划青年项目首席科学家、江苏省杰青,2022年受聘为东南大学生命科学与技术学院教授。主要研究成果包括建立了BMP信号通路调控肠道细胞分化的新机制,发现了决定肠吸收细胞系命运的关键因子;揭示了肠道干细胞更新中的重要代谢调控新机制;发现了影响肠道发育的关键转录因子调控网络;发现了肠损伤治疗的新策略等。以第一作者或通讯作者在Nature Genetics、Cell Stem Cell、Gastroenterology、Nature Communications等国际著名学术期刊上发表文章20篇;并以共同作者在Genes & Development、PNAS等发表文章18篇;因发现转录因子HNF4与抑癌基因在肠道的前馈调控获得Gallo Award for Outstanding Cancer Research,并获得了Early-Career Investigator Fellowship Award。陈磊教授有着丰富的项目研究经验,主持并完成了美国新泽西州癌症研究委员会资助项目,现主持国家自然科学基金项目、国家重点研发计划青年科学家项目、江苏省杰出青年项目、南京留学人员科技创新项目择优资助等科研项目;同时参与了多项美国国立卫生研究院R01科研项目、香港研究资助局项目、澳门科学技术发展基金委研究项目。

《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。