|
|
|
|
|
丛斌教授等:细胞化学场与细胞稳态 Engineering |
|
|
论文标题:Cellular Chemical Field and Cellular Homeostasis
期刊:Engineering
DOI:https://doi.org/10.1016/j.eng.2024.03.001
微信链接:点击此处阅读微信文章

作者:丛斌, 李璐, 王茜, 何涛, 李俊威, 谢红亮, 张奥林, 范骁辉
1 引言
机体生命活动依赖于细胞内各类分子互作形成的复杂网络调控动态过程,这一过程的有序与否,决定着细胞的结构与功能状态。细胞内复杂的网络调控表型是细胞内多组学规律有序的系统动态变化,此变化也是细胞稳态的表征形式。细胞内各类分子间结构的动态适配对接和互作是细胞稳态的分子动力学基础,此乃复杂的化学过程,需依赖细胞内稳定适宜的化学微环境。有些细胞功能和结构改变的机制可能并非是细胞内分子或细胞亚结构本身的变化,而是由于细胞内化学场稳态失衡导致的分子互作模式改变、信号转导通路网络紊乱所致。多数疾病可能源于细胞代谢异常,而细胞代谢异常最先出现的表征可能就是细胞内化学场稳态失衡,这种稳态失衡又加重了细胞结构和功能的异常,如此往复,形成恶性循环。本文尝试从细胞内微环境化学平衡角度阐释其与细胞稳态维持、疾病发生和转归的关系,提出细胞化学场这一新的概念及它的构成要素,并进一步阐述细胞化学场对细胞功能和代谢的影响,及其在疾病诊治中的可能价值。
2 化学场的概念
表征亚细胞及分子水平的微观结构及其空间分布,解析这些结构间的网络化关联关系,揭示结构间网络化互作的动态时空变化规律,是系统生物医学领域亟待研究的三大基础科学问题[1],也是破解疾病机制、研发新药的科学基础。通过对这些科学问题的研究,可以揭示基因组、表观遗传组、转录组和蛋白质组等多组学的网络化相互作用规律和功能表型,以实现基础科学、临床医学、药学领域零到一的突破。疾病的发生、发展虽然与人体的代谢、内分泌、免疫功能和遗传信息等因素相关,但还不能忽略影响细胞结构和功能的另一些重要因素——细胞内的化学变化[2]。
细胞内化学稳态维持与人体健康高度相关。然而,目前尚未发现从细胞内化学微环境变化的视角来系统研究细胞结构和功能变化、疾病的发生和诊治。对于复杂疾病研究的通常思路是寻找信号通路中的关键信号分子,研发具有靶向作用的小分子化药或生物药。事实上,细胞内的微观真实世界是众多分子间的网络化相互作用,亦或药靶互作,均需要细胞内适宜稳定的化学微环境[3]。如果化学微环境紊乱,可能会影响某些分子间的相互作用,从而影响细胞内正常的生物信息和能量传递,导致细胞稳态失衡而发生疾病。
2002年,Anton [4]概括了生物场的概念,用以描述生物体内物质的关联性和动态变化,体内有不同的场作用。细胞内化合物间互作需要适宜的化学微环境[5]。例如,蛋白质在等电点环境中最不稳定,溶解度最小,易形成聚集体;再如,信号分子的互作需要其所在微环境具有一定的酸碱度和离子浓度。基于上述,笔者提出细胞化学场的概念。细胞化学场是指细胞内各种化学变化所形成的具有一定缓冲能力的化学微环境,该微环境是细胞内多组学物质时相性动态网络互作,细胞内外的物质、信息、能量传递、交换,以维持细胞功能稳态、结构稳定的必要条件(图1)。之所以称其为“场”,是因为细胞内的化学微环境本身也具有物理学上“场”的特征,即能量、动量和质量在一定条件下可以与物质相互转化[6],细胞化学场也可以被多种细胞内外因素扰动和调节。细胞化学场概念的提出,旨在从新的视角理解疾病的发生和发展规律,从细胞化学变化过程的稳态平衡角度评估人体的健康状态,为疾病的精确诊疗另辟蹊径。
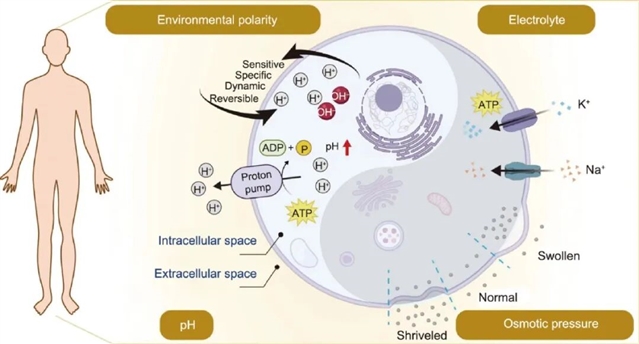
图1 细胞化学场与细胞稳态。我们将细胞化学场定义为体内细胞的协调状态,受环境极性、电解质、pH值和渗透压等因素的影响。如图所示,环境极性能够动态、灵敏、可逆且特异地调节环境中的极性离子,以维持细胞化学场的平衡。例如,细胞膜两侧电解质浓度(Na+、K+)的差异可以维持细胞膜两侧的电位差。质子泵通过运输细胞膜上的H?来维持细胞内外的pH值稳定。渗透压直接影响细胞形态,适当的渗透压有利于细胞内外正常功能的维持。此外,细胞中央的太极图展示了细胞化学场的阴阳平衡。我们强调,在正常情况下,身体甚至单个细胞始终处于动态平衡状态。ATP:三磷酸腺苷;ADP:二磷酸腺苷。
3 细胞化学场的构成要素
机体化学环境的稳态对于维持人体生理功能至关重要[7]。人体是一个完整的动态平衡系统,局部系于整体,整体关联局部。作为构成机体的基本单元,细胞的结构稳定和功能维持也需要稳定的化学环境,即化学场稳态。本文将影响细胞化学场稳态的因素概括为细胞内化学环境极性、离子浓度、酸碱度和渗透压,这些即为细胞化学场的构成要素。
3.1 细胞内化学环境极性
环境极性是指溶剂或介质对于极性分子或离子的溶解能力或亲和力表征[8]。细胞内化学环境极性会影响化学场中溶剂或介质的分子间作用力,以及溶质或介质的分子运动状态,进而影响细胞内外物质、能量、信息的交换。
影响细胞内化学环境极性的因素主要包括[9]:①环境中的分子种类及其比例。不同种类和比例的分子混合在一起,会形成不同极性的混合物。②环境温度和压力的变化。温度和压力会影响分子之间的距离和运动状态,从而影响分子之间的相互作用力。一般而言,温度升高或压力降低,会使分子间距离增大,运动更加自由,相互作用力减弱,环境极性降低;反之,温度降低或压力升高,会使分子之间距离缩小,运动受限,相互作用力增强,环境极性升高。③环境中电场和磁场的变化。电场和磁场会使非极性或弱极性的分子极性更强,或使强极性的分子更不对称,从而增加环境极性。
检测分析环境极性的方法较多,主要有两大类:电学方法和化学方法。电学方法是利用电流、电压、电阻、电容、电感等电学参数来测量环境极性。常用的电学方法主要有电阻率法[10]、诱导极化法[11]、介电常数法等。化学方法是利用不同化合物在不同极性介质中的溶解度、吸附性、荧光强度等化学特性来测量环境极性。常用的化学方法主要有溶解度法、吸附法、荧光法[12]等。
3.2 电解质
电解质是指溶于水溶液中或在熔融状态下自身能够导电的化合物。电解质平衡是保证细胞内渗透压稳定、维持细胞功能与正常代谢的化学基础。电解质主要包括钠、钾、钙、镁等阳离子以及磷、氯等阴离子。通常,细胞内液电解质的阴离子总数与阳离子总数相等,在一定范围内保持电中性。当其中任何一种电解质数量异常时,电解质平衡被打破而影响分子间互作,细胞会发生不同程度的功能紊乱和结构改变。电解质紊乱涉及许多疾病过程[13]。
影响电解质平衡的主要因素包括:①离子通道。细胞的新陈代谢需要持续地与周围环境进行物质交换。细胞膜上的离子通道是细胞内外物质交换的重要途径。离子通道调节特定离子进出细胞,维持细胞功能。②水通道。水通道蛋白具有高度选择性,只允许水分子跨膜运输而不允许带电质子或其他离子通过。水在细胞膜两侧转运会影响细胞内钠离子的浓度[14]。
细胞内电解质的检测主要包括荧光探针法[15]、微电极法[16]和膜片钳[17]等。荧光探针法是将探针选择性地与特定离子结合,通过检测荧光强度测定目标离子的浓度。微电极是一种微小的电极,可以插入细胞中测量特定离子的浓度,这些电极对离子具有选择性,可产生与特定离子浓度成比例的电信号。膜片钳技术有电压钳和电流钳两种模式。在电压钳模式下,设备通过负反馈电路维持细胞跨膜电位在某一数值,从而观察跨膜电流的变化;在电流钳模式下,微电极向细胞内注入恒定或变化的电流,记录相应膜电位的变化,如动作电位的形成。
3.3 酸碱度
pH值是衡量溶液酸性或碱性程度的指标,其数学定义是氢离子浓度[H+]的负对数[18]。pH值对细胞化学场的稳态维持具有重要意义。细胞内pH值关系到细胞内、外物质和能量的交换,分子互作动态平衡等事件。理论上,细胞内酸碱平衡紊乱会严重影响表观遗传修饰、基因转录、生物大分子构象稳定性、物质代谢等生物学过程。
pH值受离子转运系统、细胞内离子浓度等诸多因素影响。例如,高尔基体内的pH值受液泡-腺苷三磷酸酶(V-ATP酶)、反离子(Cl-或K+)转运和将质子从高尔基体腔运回细胞质的质子“泄漏”途径三个系统以及Ca2+、Mg2+、Mn2+浓度的调节[19–21]。
目前有多种测量细胞内pH值(pHi)和细胞外pH值(pHe)的方法,包括pH敏感核磁共振波谱[22]、正电子发射断层扫描[23]、放射性示踪剂、磁共振成像[24]、光学成像[25]和不同类型的电化学传感器。值得注意的是,Anderson等[26]开发了一种新的定位于细胞表面的pH敏感的荧光染料SNARF,用以测定离体组织细胞表面pH值。玻璃纳米孔道技术可作为纳米级注射器实现单细胞的分析,目前已经实现了基于多种不同孔径的纳米孔的pHi和单个分子的精准分析。
3.4 渗透压
渗透压是指维持仅允许溶剂通过的膜所隔开的溶剂与纯溶剂之间的渗透平衡所需的附加压力[27]。影响细胞内渗透压的因素主要包括离子浓度、蛋白质浓度、水平衡等。离子等小分子物质形成晶体渗透压,蛋白质等大分子物质构成胶体渗透压。细胞内液和细胞外液渗透压主要由离子和蛋白质浓度调节。细胞内液和细胞外液渗透压基本相等,以维持细胞的正常形态和功能。当膜两侧离子浓度存在差异时,会出现渗透现象,引发水分子跨膜转运,导致脱水或水肿。因此,细胞内液渗透压的变化可以反映细胞内化学场的稳态。
细胞内渗透压可以使用冰点渗透压仪测定[28]。其原理是利用冰点降低水的渗透压的特性,将待测样品与等体积的纯水混合,降低样品中的溶质浓度,从而使其渗透压与纯水的渗透压相等。
3.5 化学场要素的关联性
笔者认为,与细胞能量代谢障碍、离子通道结构或功能异常、细胞内信号转导异常、基因转录异常、生物大分子装配异常、细胞内分子互作异常等相关的疾病的发生和发展,可能都与细胞内化学场稳态失衡有关,因为上述生物学过程均需要细胞提供适宜的离子浓度、酸碱度、渗透压和细胞内化学环境极性。细胞异常可能最先出现的表征就是细胞内化学场稳态失衡,这种稳态失衡又加重了细胞代谢异常,如此往复,形成恶性循环。当然,这些假设需要通过系统深入研究去证实。
2008年Cell期刊上的一项研究证实[29],细胞极性蛋白Scribble的丢失,会引发细胞变成不受控的快速分裂增殖的类型,导致恶变、促进癌症发生。碱提供电子、酸获得电子,极性键加强了电子的不均衡分布,改变细胞内化学环境极性,或发生化学反应时更容易表现出“酸性或碱性”。为了使细胞免于酸中毒,癌细胞糖酵解产生的H+需要释放到细胞外,H+浓度增高导致细胞外环境的酸化,为癌细胞的侵袭和转移提供了条件。较公认的观点是,肿瘤组织中常见高酸性区域,通常位于缺少氧气的部位。细胞微环境pH值对恶性肿瘤的诊断和治疗具有一定参考意义。2019年美国麻省理工学院研究团队首次证明[30],偏酸性可触发Mena亚型(MenaINV)和分化簇44(CD44)的可变剪接,揭示肿瘤酸中毒促进了与细胞侵袭和转移性相关的分子表达。这种重编程(应对细胞外pH值降低的细胞内反应)使得癌细胞能在低pH值环境中生存并增殖。酸性环境有助于肿瘤细胞产生使其更具攻击性的蛋白质。如参考文献[31]所述,钾离子浓度的变化可影响免疫疗法的治疗效果。在肿瘤细胞内,无氧酵解酶活性加强,中间代谢产物大量累积,细胞内渗透压上升,引起一系列生理变化,导致细胞死亡。
4 化学场对细胞功能和代谢的影响及调节
肿瘤细胞与正常细胞在代谢上存在较大差异。为了维持庞大的合成代谢需求,肿瘤细胞采用了与普通体细胞不同的代谢机制。如果能够人为干预肿瘤细胞这种合成代谢所需的化学场,将是肿瘤治疗的一个新策略。如参考文献[32]所述,细胞代谢是癌细胞和免疫细胞维持活力和功能的关键因素。肿瘤代谢本身就可以限制免疫检查点对肿瘤细胞的监视[32],从而确保免疫逃逸和癌症存活。因此,了解包括对癌症的免疫反应在内的各种细胞的不同代谢对细胞化学条件的需求,可以选择性调节免疫细胞功能,从定向调控细胞内化学场变化角度,开辟疾病精准诊疗的新途径。
4.1 细胞内化学环境极性
细胞内化学环境极性的改变会影响细胞内的各种生物化学过程,涉及物质代谢、能量转换、信号转导等。环境极性的改变也会影响化学场中物质的电荷分布、电磁场、光谱特征等,进而影响细胞内各种物理信号的传递。这些物理信号可能影响细胞间的通信、细胞内的信号转导、基因表达调控等重要环节。环境极性的改变还会影响化学场中物质的构象变化,从而影响细胞内各种生物分子的活性和功能。
细胞内环境极性改变会对化学场的稳态产生影响。当环境极性增加时,可导致细胞膜的电势差增大,影响离子通道的开放和关闭,进而影响细胞内、外的离子浓度和pH值。这些变化干扰细胞内的信号转导、基因表达、酶促反应等生物化学过程,从而影响细胞的增殖、分化、迁移、凋亡等[33]。
4.2 电解质
电解质失衡会引起细胞内化学场稳态失衡,细胞代谢紊乱、细胞膜电位和细胞体积改变,还可影响蛋白质合成和代谢,加速细胞凋亡或死亡[34]。
细胞内、外阳离子的浓度差是维持细胞膜电位的关键因素[35]。细胞内的阳离子主要是钾离子[36],钾离子的缺乏或过量均会严重影响细胞功能[37?38]。钙离子的平衡紊乱会影响细胞膜两侧的生物电位,导致化学场稳态失衡,影响神经-肌肉传导功能[39]。储存在线粒体中的镁离子是碳水化合物和脂肪代谢中必不可少的辅助因子。当镁离子水平受到干扰时,能量产生过程,特别是三磷酸腺苷的合成就会中断,细胞能量不足可能会发展为细胞功能障碍甚至死亡[40]。此外,钙离子移出细胞的过程需要镁离子协助,镁离子不足可能会阻碍钙外流,细胞因此会受到过度刺激而受损,甚至死亡[41]。
4.3 酸碱度
细胞化学场pH值变化可影响物质的电离状态、蛋白质结构等,从而影响细胞的各种生物化学过程。例如,在细胞膜上负责转运亲水性核苷的核苷转运蛋白3(ENT3),是一种依赖酸性激活的溶酶体转运蛋白,对核苷酸合成和嘌呤能信号转导至关重要。Rahman等[42]研究发现,ENT3的转运活性强烈依赖于酸碱度,在pH值为5.5时活性最高,酸碱平衡失调可导致细胞生物学过程失活,Asp-219和Glu-447的电离状态决定了转运蛋白ENT3的pH依赖性运输激活状态。因此,化学场pH值的变化可导致ENT3转运蛋白结构的失活。化学场pH值的改变也会影响生物分子的结构,研究表明pH值的改变对阿尔兹海默病至关重要。当pHi较低时,淀粉样蛋白-β肽(Aβ)存在于神经元内涵体中。当pH值降低到与内涵体内pH值相同时,Aβ组装成Aβ寡聚体(AβO)的速率加快8000倍,同时伴随淀粉样蛋白原纤维的形成[43]。
4.4 渗透压
细胞内液和细胞外液渗透压基本相等,有利于维持细胞的正常形态和功能。当两者的平衡被打破时,会导致化学势的变化。化学势变化的本质,是由于细胞内、外渗透压失衡影响了电解质的移动方向,引起细胞内化学场稳态失衡。细胞内渗透压的改变对细胞蛋白活性的影响十分显著。研究表明,细胞内高渗溶液能够加速爪蟾卵母细胞中表达的Kv 1.4 K+水通道蛋白的失活。此外,细胞内渗透压还显著抑制与蛋白活性恢复相关的细胞内电流[44]。另一研究表明,细胞内Na+浓度和渗透压升高能够增强与E6AP羧基末端同源(HECT)家族E3 Nedd4-2/Nedd4L的活性,E3泛素化连接酶的活性对细胞功能至关重要[45]。
哺乳动物细胞通过调节细胞内渗透压来调节其体积,而细胞体积调节也是早期胚胎发育的关键过程。研究表明,早期植入前小鼠胚胎需要细胞内积累甘氨酸来提供渗透支持,从而控制细胞体积。在排卵期减数分裂成熟过程中被激活的甘氨酸转运蛋白1(GLYT1),能够介导小鼠胚胎(也可能在人类胚胎)中调节渗透压的甘氨酸积累[46?47]。此外,原肠胚形成过程中,间质液渗透压能够通过调节细胞表面张力驱动祖细胞向不同细胞类型定向分化。这些调节作用都有利于维持细胞内、外化学场的稳态。
5 对化学场变化响应敏感的细胞
对细胞化学场变化响应敏感的可能是那些代谢增殖活跃的组织细胞,如生殖细胞、干细胞、胚胎组织细胞、肝细胞、上皮组织细胞、肿瘤细胞等。因此,研究胚胎发育、恶性肿瘤发生、组织再生等生物学过程,应考虑细胞化学场变化的影响因素。例如,氨基酸代谢的改变既是疾病进展的临床指标,也可作为治疗策略。如参考文献[48]所述,氨基酸代谢可能与细胞化学场的稳态密切相关。此外,通过神经-体液-内分泌系统的整体调节,可维系细胞外液的化学环境稳态,并借助细胞膜受体信号转导、离子通道门控、细胞内外物质交换等来调节维持细胞内化学场稳态。
6 化学场在疾病诊断和治疗中的应用价值
细胞内环境极性改变可作为化学场稳态的一种可探测表型以反映细胞的功能状态和病理变化。纳米颗粒可以通过与特定配体结合,利用细胞内环境极性的变化,增加其在细胞内的摄取,提高抗感染药物的靶向性、稳定性和生物利用度。利用特定化学场环境,实现药物的可控释放,可有效地对抗细胞内的病原体,提高治疗效果并降低副作用[6]。例如,一些纳米载体可以在酸性或还原性的细胞内环境中发生降解或解离,促进药物释放,改善某些疾病的治疗效果[49?50]。随着纳米技术和生物工程的快速发展,基于细胞内化学场条件的新型诊断和治疗策略将会不断涌现。
电解质在维持机体细胞内、外化学平衡中发挥关键作用。有些疾病及其严重程度可能归因于与之相关的细胞内电解质的紊乱程度[51]。细胞内电解质异常也可作为某些疾病的早期或隐匿阶段的表征。
细胞内酸碱度是细胞化学场稳态的重要表征。精准调节细胞内pH值可能是治疗某些疾病的有效手段。值得注意的是,癌细胞的pHi和pHe与正常细胞不同。在非癌组织中,pHi和pHe分别为7.2和7.5,而在癌组织中,pHi升高至7.5,pHe为6.4~7.1 [52?53]。偏酸性的癌组织微环境和细胞内区室已成为成像和治疗的靶点[54],细胞微环境pH值对癌症诊断和治疗具有一定的意义。细胞内酸碱平衡失调是乳腺恶性肿瘤的一个常见因素。Na+/H+交换器亚型1(NHE1)是一种关键的pH调节蛋白,参与乳腺癌细胞质子排出[55],其活性增加导致细胞内碱化和细胞外酸化,从而促进癌症进展[56]。为了使细胞免于酸中毒,癌细胞糖酵解产生的H+需要释放到细胞外。细胞外环境的酸化为癌症细胞的侵袭和转移提供了条件,而调节癌细胞pHi有可能抑制转移性细胞表型的进展,并避免多种化疗药物的耐药。
7 结论与展望
本文提出了细胞化学场这一概念,有关化学场的理论及其应用可能会为药物研发和精准医疗等基础和临床研究提供新的思路。
从化学场稳态失衡的视角研究细胞功能和结构变化,可另辟蹊径,衍生出新的基础与临床研究方向。多数疾病可归为某种器官区域性的变化,这些变化多是源于细胞内的代谢异常,而细胞内代谢异常可能最先出现的表型特征就是细胞内化学场稳态失衡,这种稳态失衡又加重了细胞代谢紊乱,如此往复,形成恶性循环。器官微循环障碍引起的区域性细胞外环境稳态失衡、细胞缺氧、能量代谢障碍等,可能是细胞化学场稳态失衡的始动因素。对器官区域性的疾病,在隐匿期或早期阶段,通过检测细胞化学环境变化,建立和实现疾病预警机制,并及时对其进行干预,恢复细胞内化学平衡,可望实现疾病的早期诊断和治疗。
探索细胞化学场的变化规律和稳态机制具有重要的生物学意义和应用价值。随着计算机科学技术和生物工程技术的快速发展,有关细胞化学场的理论和技术可以用于开展人类生命健康与疾病相关研究。
一是开创单细胞化学场检测技术。目前,细胞化学场的检测主要依赖于荧光探针或纳米传感器等方法,但这些方法存在一定的局限性,如荧光探针可能影响细胞内环境或被代谢降解,而纳米传感器可能引起细胞毒性或免疫反应等。因此,亟需开发更加创新、智能、灵敏和高分辨的单细胞化学场检测技术,以实现对细胞内各种化学物质的实时、动态和定量监测。这些技术可以与数字信息化模型结合,利用机器学习或深度学习等方法,对细胞化学场的数据进行分析和预测,从提高智能化、灵敏度、分辨率等角度优化现有检测方法,从而揭示细胞化学场与细胞功能、结构和疾病发生、发展之间的关系。
二是研发定向导入细胞内的能够调节细胞内化学平衡的极性分子化合物。以肿瘤为例,由各种因素引起的蛋白酪氨酸激酶(PTKs)的异常激活会影响细胞功能,导致异常生长和癌变,而抑制异常的PTK功能可以抑制肿瘤生长。目前,酪氨酸激酶抑制剂(TKIs)作为PTKs的靶向特异性抑制剂,已被用于恶性肿瘤和癌症的靶向治疗。但是,其耐药性的出现大大限制了TKIs的疗效。2023年Signal Transduction Targeted Therapy期刊综述了TKI的耐药性机制[57]。笔者认为,这可能是在长期用药后,靶细胞内化学场稳态失衡,TKIs与靶点之间的化学适配结合明显减弱所致。若基于化学场稳态理论,从定向调节细胞内化学平衡角度进行治疗,可能会逆转TKIs的耐药性。
三是拓展丰富细胞化学场应用领域。目前,细胞化学场的应用以体外或动物模型为主,但这些模型不能完全模拟人体复杂的生理和病理状态。因此,需要拓展细胞化学场的应用领域,以评估人体功能状态和疾病风险。可以与单细胞检测技术、人源生物工程技术结合,利用人源类器官三维模型、生物打印结合微流控技术,将人体各个器官或组织的细胞化学场可视化和定量化,从而实现对人体健康状况的全面和精准的评估,并提供个性化诊断和替代治疗方案。
致谢
衷心感谢香港中文大学的Chi Chiu Wang教授、Tsz Ching Yeung女士,澳大利亚塔斯马尼亚医学院的Wui Tin Justto Li女士,在提升稿件的语言表达方面提供的帮助。
这项工作由国家自然科学基金重大项目(82293651)、重点项目(82130055),中国医学科学院医学与健康科技创新工程项目(2019-I2M-5-055)以及浙江省“尖兵”“领雁”研发攻关计划(2023C03004)资助。
参考文献
[1]Cong B, Liu XA, Zhang S, Ni Z, Wang L. Revolutionizing the life sciences by developing a holographic digital mannequin. Engineering 2023;27:14-17..
[2]L. Castelo-Soccio, H. Kim, M. Gadina, P.L. Schwartzberg, A. Laurence, J.J. O’Shea. Protein kinases: drug targets for immunological disorders. Nat Rev Immunol, 23 (12) (2023), pp. 787-806.
[3]T. Söllner, S.W. Whiteheart, M. Brunner, H. Erdjument-Bromage, S. Geromanos, P. Tempst, et al. SNAP receptors implicated in vesicle targeting and fusion. Nature, 362 (6418) (1993), pp. 318-324.
[4]M. Anton. New York City (Readers of the book of life: contextualizing developmental evolutionary biology. (1st ed.ed.), Oxford University Press, 2002).
[5]S.S. Ranade, S.H. Woo, A.E. Dubin, R.A. Moshourab, C. Wetzel, M. Petrus, et al. Piezo 2 is the major transducer of mechanical forces for touch sensation in mice. Nature, 516 (7529) (2014), pp. 121-125.
[6]S. SenGupta, C.A. Parent, J.E. Bear. The principles of directed cell migration. Nat Rev Mol Cell Biol, 22 (8) (2021), pp. 529-547.
[7]S. Naik, S.B. Larsen, C.J. Cowley, E. Fuchs. Two to tango: dialog between immunity and stem cells in health and disease. Cell, 175 (4) (2018), pp. 908-920.
[8]T. Barkay, A.J. Poulain. Mercury (micro)biogeochemistry in polar environments. FEMS Microbiol Ecol, 59 (2) (2007), pp. 232-241.
[9]T.C. Owyong, P. Subedi, J. Deng, E. Hinde, J.J. Paxman, J.M. White, et al. A molecular chameleon for mapping subcellular polarity in an unfolded proteome environment. Angew Chem Int Ed Engl, 59 (25) (2020), pp. 10129-10135.
[10]S. Knoll, T. Rösch, C. Huhn. Trends in sample preparation and separation methods for the analysis of very polar and ionic compounds in environmental water and biota samples. Anal Bioanal Chem, 412 (24) (2020), pp. 6149-6165.
[11]E. Martinho. Electrical resistivity and induced polarization methods for environmental investigations: an overview. Water Air Soil Pollut, 234 (4) (2023), p. 215.
[12]T. Maes, R. Jessop, N. Wellner, K. Haupt, A.G. Mayes. A rapid-screening approach to detect and quantify microplastics based on fluorescent tagging with Nile Red. Sci Rep, 7 (1) (2017), p. 44501.
[13]K.O. Alfarouk, S.B.M. Ahmed, A. Ahmed, R.L. Elliott, M.E. Ibrahim, H.S. Ali, et al. The interplay of dysregulated pH and electrolyte imbalance in cancer. Cancers, 12 (4) (2020), p. 898.
[14]L.B. Baker. Sweating rate and sweat sodium concentration in athletes: a review of methodology and intra/interindividual variability. Sports Med, 47 (S1) (2017), pp. 111-128.
[15]S. Eitelmann, J. Stephan, K. Everaerts, S. Durry, N. Pape, N.J. Gerkau, et al. Changes in astroglial K+ upon brief periods of energy deprivation in the mouse neocortex. Int J Mol Sci, 23 (9) (2022), p. 4836.
[16]S. Brouwer, T. Hoffmeister, A. Gresch, L. Schönhoff, M. Düfer. Resveratrol influences pancreatic islets by opposing effects on electrical activity and insulin release. Mol Nutr Food Res, 62 (5) (2018), p. 1700902.
[17]D. Lovisolo. Patch clamp: the first four decades of a technique that revolutionized electrophysiology and beyond. Rev Physiol Biochem Pharmacol, 186 (2023), pp. 1-28.
[18]Steinegger O.S. Wolfbeis S.M. Borisov. Optical sensing and imaging of pH values: spectroscopies, materials, and applications. Chem Rev, 120 (22) (2020), pp. 12357-12489.
[19]N. Demaurex. pH homeostasis of cellular organelles. News Physiol Sci, 17 (2002), pp. 1-5.
[20]P. Paroutis, N. Touret, S. Grinstein. The pH of the secretory pathway: measurement, determinants, and regulation. Physiology, 19 (4) (2004), pp. 207-215.
[21]M.M. Wu, M. Grabe, S. Adams, R.Y. Tsien, H.P. Moore, T.E. Machen. Mechanisms of pH regulation in the regulated secretory pathway. J Biol Chem, 276 (35) (2001), pp. 33027-33035.
[22]J.S. Cohen, M. Motiei, S. Carmi, D. Shiperto, O. Yefet, I. Ringel. Determination of intracellular pH and compartmentation using diffusion-weighted NMR spectroscopy with pH-sensitive indicators. Magn Reson Med, 51 (5) (2004), pp. 900-903.
[23]A.L. Vavere, G.B. Biddlecombe, W.M. Spees, J.R. Garbow, D. Wijesinghe, O.A. Andreev, et al. A novel technology for the imaging of acidic prostate tumors by positron emission tomography. Cancer Res, 69 (10) (2009), pp. 4510-4516.
[24]R.J. Gillies, D.L. Morse. In vivo magnetic resonance spectroscopy in cancer. Annu Rev Biomed Eng, 7 (1) (2005), pp. 287-326.
[25]M. Hassan, J. Riley, V. Chernomordik, P. Smith, R. Pursley, S.B. Lee, et al. Fluorescence lifetime imaging system for in vivo studies. Mol Imaging, 6 (4) (2007), pp. 229-236.
[26]M. Anderson, A. Moshnikova, D.M. Engelman, Y.K. Reshetnyak, O.A. Andreev. Probe for the measurement of cell surface pH in vivo and ex vivo. Proc Natl Acad Sci USA, 113 (29) (2016), pp. 8177-8181.
[27]SAC/TC16.GB/T 3102.8-1993: Quantities and units of physical chemistry and molecular physics. Chinese standard. Beijing: Standardization Administration of the People’s Republic of China; 1993. Chinese.
[28]J. Lemière, P. Real-Calderon, L.J. Holt, T.G. Fai, F. Chang. Control of nuclear size by osmotic forces in Schizosaccharomyces pombe. eLife, 11 (2022), p. e76075.
[29]J.H. Yeh, S.S. Sidhu, A.C. Chan. Regulation of a late phase of T cell polarity and effector functions by CRTAM. Cell, 132 (5) (2008), pp. 846-859.
[30]N. Rohani, L. Hao, M.S. Alexis, B.A. Joughin, K. Krismer, M.N. Moufarrej, et al. Acidification of tumor at stromal boundaries drives transcriptome alterations associated with aggressive phenotypes. Cancer Res, 79 (8) (2019), pp. 1952-1966.
[31]S.K. Vodnala, R. Eil, R.J. Kishton, M. Sukumar, T.N. Yamamoto, N.H. Ha, et al. T cell stemness and dysfunction in tumors are triggered by a common mechanism. Science, 363 (6434) (2019), p. eaau0135.
[32]R.D. Leone, J.D. Powell. Metabolism of immune cells in cancer. Nat Rev Cancer, 20 (9) (2020), pp. 516-531.
[33]L.M. Doyle, M.Z. Wang. Overview of extracellular vesicles, their origin, composition, purpose, and methods for exosome isolation and analysis. Cells, 8 (7) (2019), p. 727.
[34]D. Bennet, Y. Khorsandian, J. Pelusi, A. Mirabella, P. Pirrotte, F. Zenhausern. Molecular and physical technologies for monitoring fluid and electrolyte imbalance: a focus on cancer population. Clin Transl Med, 11 (6) (2021), p. e461.
[35]F.M. Pinto, A. Odriozola, L. Candenas, N. Subirán. The role of sperm membrane potential and ion channels in regulating sperm function. Int J Mol Sci, 24 (8) (2023), p. 6995.
[36]H.R. Pohl, J.S. Wheeler, H.E. Murray. Sodium and potassium in health and disease. Met Ions Life Sci, 13 (2013), pp. 29-47.
[37]B.F. Palmer. Potassium binders for hyperkalemia in chronic kidney disease-diet, renin-angiotensin-aldosterone system inhibitor therapy, and hemodialysis. Mayo Clin Proc, 95 (2) (2020), pp. 339-354.
[38]R.J. Unwin, F.C. Luft, D.G. Shirley. Pathophysiology and management of hypokalemia: a clinical perspective. Nat Rev Nephrol, 7 (2) (2011), pp. 75-84.
[39]D. Eisner, E. Neher, H. Taschenberger, G. Smith. Physiology of intracellular calcium buffering. Physiol Rev, 103 (4) (2023), pp. 2767-2845.
[40]F.P. Buelens, H. Leonov, B.L. de Groot, H. Grubmüller. ATP-magnesium coordination: protein structure-based force field evaluation and corrections. J Chem Theory Comput, 17 (3) (2021), pp. 1922-1930.
[41]E. Helte, A. Åkesson, S.C. Larsson. Assessing causality in associations of serum calcium and magnesium levels with heart failure: a two-sample mendelian randomization study. Front Genet, 10 (2019), p. 1069.
[42]M.F. Rahman, C. Askwith, R. Govindarajan. Molecular determinants of acidic pH-dependent transport of human equilibrative nucleoside transporter 3. J Biol Chem, 292 (36) (2017), pp. 14775-14785.
[43]M.P. Schutzmann, F. Hasecke, S. Bachmann, M. Zielinski, S. Hänsch, G.F. Schröder, et al. Endo-lysosomal Aβ concentration and pH trigger formation of Aβ oligomers that potently induce Tau missorting. Nat Commun, 12 (1) (2021), p. 4634.
[44]X. Jiang, G.C. Bett, X. Li, V.E. Bondarenko, R.L. Rasmusson. C-type inactivation involves a significant decrease in the intracellular aqueous pore volume of Kv1.4 K+ channels expressed in Xenopus oocytes. J Physiol, 549 (Pt 3) (2003), pp. 683-695.
[45]Persaud C. Jiang Z. Liu G. Kefalas W.L. Demian D. Rotin.Elevated intracellular Na+ and osmolarity stimulate catalytic activity of the ubiquitin ligaseNedd4-2. Proc Natl Acad Sci USA, 119 (30) (2022), Article e2122495119.
[46]J.M. Baltz, A.P. Tartia. Cell volume regulation in oocytes and early embryos: connecting physiology to successful culture media. Hum Reprod Update, 16 (2) (2010), pp. 166-176.
[47]S. Richard, A.P. Tartia, D. Boison, J.M. Baltz. Mouse oocytes acquire mechanisms that permit independent cell volume regulation at the end of oogenesis. J Cell Physiol, 232 (9) (2017), pp. 2436-2446.
[48]Z.N. Ling, Y.F. Jiang, J.N. Ru, J.H. Lu, B. Ding, J. Wu. Amino acid metabolism in health and disease. Signal Transduct Target Ther, 8 (1) (2023), p. 345.
[49]L.N. Borgheti-Cardoso, J.S.R. Viegas, A.V.P. Silvestrini, A.L. Caron, F.G. Praça, M. Kravicz, et al. Nanotechnology approaches in the current therapy of skin cancer. Adv Drug Deliv Rev, 153 (2020), pp. 109-136.
[50]Ray A.K. Mitra. Mitra K. Cholkar A. Chapter 8—nanotechnology in intracellular trafficking, imaging, and delivery of therapeutic agents. A.K. Mandal (Eds.), Emerging nanotechnologies for diagnostics, drug delivery and medical devices, Elsevier, Boston (2017), pp. 169-188.
[51]A.K. Balci, O. Koksal, A. Kose, E. Armagan, F. Ozdemir, T. Inal, et al. General characteristics of patients with electrolyte imbalance admitted to emergency department. World J Emerg Med, 4 (2) (2013), pp. 113-116.
[52]S.Y. Choi, C.C. Collins, P.W. Gout, Y. Wang. Cancer-generated lactic acid: a regulatory, immunosuppressive metabolite>. J Pathol, 230 (4) (2013), pp. 350-355.
[53]B.A. Webb, M. Chimenti, M.P. Jacobson, D.L. Barber. Dysregulated pH: a perfect storm for cancer progression. Nat Rev Cancer, 11 (9) (2011), pp. 671-677.
[54]F. Cappellesso, M.P. Orban, N. Shirgaonkar, E. Berardi, J. Serneels, M.A. Neveu, et al. Targeting the bicarbonate transporter SLC4A 4 overcomes immunosuppression and immunotherapy resistance in pancreatic cancer. Nat Can, 3 (12) (2022), pp. 1464-1483.
[55]S. Wakabayashi, M. Shigekawa, J. Pouyssegur. Molecular physiology of vertebrate Na+/H+ exchangers. Physiol Rev, 77 (1) (1997), pp. 51-74.
[56]R.A. Cardone, V. Casavola, S.J. Reshkin. The role of disturbed pH dynamics and the Na+/H+ exchanger in metastasis. Nat Rev Cancer, 5 (10) (2005), pp. 786-795.
[57]Y. Yang, S. Li, Y. Wang, Y. Zhao, Q. Li. Protein tyrosine kinase inhibitor resistance in malignant tumors: molecular mechanisms and future perspective. Signal Transduct Target Ther, 7 (1) (2022), p. 329.
引用本文:
Bin Cong, Lu Li, Qian Wang, Tao He, Junwei Li, Hongliang Xie, Aolin Zhang, Xiaohui Fan. Cellular Chemical Field and Cellular Homeostasis. Engineering, 2024, 39(8): 18–24 https://doi.org/10.1016/j.eng.2024.03.001
更多内容
哈尔滨医科大学团队发现补虚通瘀颗粒缓解心肌缺血作用机制
苦木素类化合物抗癌研究新进展:天然产物的抗癌潜力再受关注
香港中文大学新发现!片仔癀能防治脂肪性肝炎
让AI更智能,李静海院士团队提出“四一致”新范式
Engineering征稿启事:人工智能赋能工程科技
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。