|
|
|
|
|
纳米孔道蛋白质测序新方法揭示肾素-血管紧张素系统的酶串扰效应 |
|
|
北京时间2023年2月21日,南京大学化学化工学院的龙亿涛教授课题组在Nature Chemistry期刊上发表了一篇题为“Protein Nanopore Reveals the Renin-Angiotensin System Crosstalk with Single-Amino-Acid Resolution”的研究成果。
该研究报道了一种基于纳米孔道单分子界面的复杂体系分子时序变化研究策略,利用精准设计的纳米孔道单分子界面、构建的单个多肽分子测序新方法,自主搭建的微弱电流测量装置与针对性开发的单分子快速定量方法,逐个测序了多组分系统中单个氨基酸差异的血管紧张素系列肽,实时监测了血管紧张素多肽的动态演化过程,阐明了其定量演化路径,揭示了肾素-血管紧张素系统中的串扰效应,并进一步提出了SARS-CoV-2刺突蛋白及其变体对该系统的影响模型。
论文通讯作者是龙亿涛教授,第一作者是蒋杰博士、李孟寅博士。
肾素-血管紧张素系统(RAS)维持了人体的血压及电解质平衡,并深度参与和人体中枢神经系统、免疫系统的复杂相互作用。RAS失调直接导致的高血压,及其进一步引发的心脑血管疾病,是目前在全球造成死亡人数最多的疾病之一。病理性RAS激活的血压升高的传统临床疗法主要集中在对主效应肽血管紧张素II(Ang II)的干预上,包括开发针对Ang II生成的血管紧张素转化酶ACE的抑制剂,以及针对Ang II受体的拮抗剂。近年来,研究发现,另一种内源性血管紧张素转换酶ACE2,通过对Ang II的直接降解,以及对Ang II上游底物Ang I的转化,可以降低Ang II的水平。更为重要的是,最近的实验证据表明,由ACE2介导的Ang II的下游产物,Ang 1-7,在对血压调节、免疫应答等的调节中起到与Ang II完全相反的作用,表现出ACE2在传统的RAS激活中的反调节效应。因此,鉴于两种酶在RAS系列血管紧张素多肽转化中的“交叉介导”,在多组分体系中对其之间的相互影响,即串扰效应的研究将进一步为RAS调控的分子机制提供新的见解。
此外,ACE2是近年来导致新冠大流行的SARS-CoV-2病毒的主要受体,研究SARS-CoV-2刺突蛋白(Spike Protein,SP)对ACE和ACE2串扰体系的干扰,将有助于从分子层面对新冠病症的致病机制的理解。尽管目前已有研究初步揭示了ACE、ACE2各自的催化动力学、底物选择性等信息,然而,由于血管紧张素系列肽之间的单个氨基酸差异,潜在的低半衰期以及较大的动态丰度变化,对ACE和ACE2的串扰效应研究,需要克服目前单分子多肽测序速度慢、检测限高、动态范围小等世界性难题,并需要发展实时精准定量方法。
南京大学龙亿涛教授研究团队提出了基于生物纳米孔道的复杂体系分子时序演化研究策略,包括三个中心原则:设计识别单个组成单元/单个基团的高分辨率单分子界面、发展实时定量的高读取效率方法、以及构建适用于酶催化反应的类生理环境。通过对Aerolysin纳米孔道单分子界面的精准设计与工程化改造,定向增强了针对电中性的血管紧张素系列肽的检测效率,及对其之间单个氨基酸差异的分辨能力,能够在单分子水平上精准识别并高效定量复杂体系中的系列血管紧张素,包括Ang I、Ang 1-9、Ang II、Ang 1-7、Ang III等。同时,结合构建的基于有效时间的快速定量算法,该策略实时监测了ACE、ACE2对Ang I的剪切过程,计算了两者针对Ang I的动力学参数,并评估了酶对底物选择性,与传统质谱法得到的结果对比,证实了基于纳米孔道策略的可靠性。

图1:纳米孔道检测示意图及其对血管紧张素的单分子分辨。
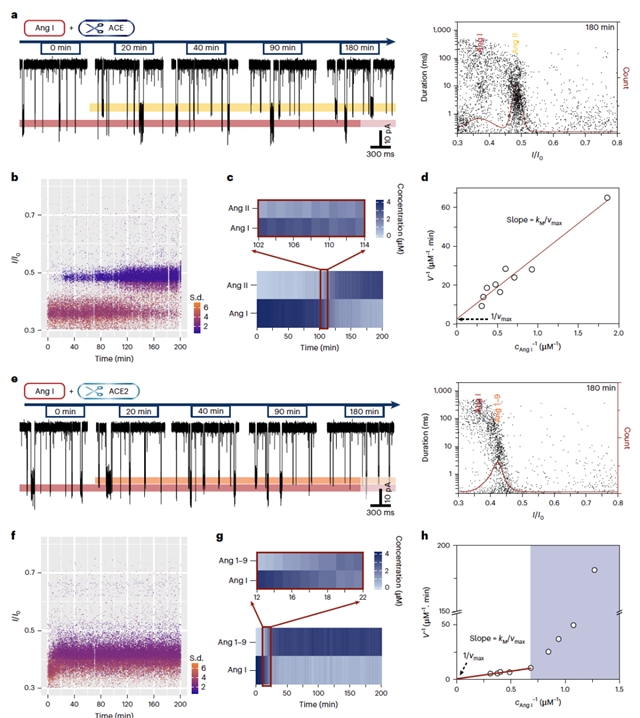
图2:实时监测酶时序性剪切过程及计算酶催化动力学参数。
通过对ACE、ACE2混合酶体系中,对单个血管紧张素多肽分子的逐个、高通量表征,描绘了ACE和ACE2同时存在时,Ang I的实时、动态演化路径,揭示了两者的串扰效应:即ACE2选择性抑制ACE对Ang I的降解,而几乎不影响ACE对其他多肽(如Ang 1-9、Ang1-7等)的剪切。这一串扰效应被证明在不同的ACE、ACE2浓度比时、不同的反应盐浓度甚至生理环境盐浓度下均存在,能够显著影响Ang I的转化路径。

图3:ACE和ACE2的串扰效应。

图4:SARS-CoV-2及其变体对串扰的影响。
鉴于ACE2是SARS-CoV-2 SP的主要受体,课题组评估了刺突蛋白SP存在下,ACE和ACE2串扰效应的变化。结果表明,SARS-CoV-2 SP能够显著降低ACE2对ACE的选择性抑制,同时增加Ang II的生成量与积累量。更为重要的是,迄今为止被认为引起最严重新冠病症的SARS-CoV-2 Delta变体,能够进一步抑制ACE2的活性:相比于野生型SP,Delta SP存在下,Ang II成为了各个时间段的主要产物,其生成与积累量分别提升了3倍与4倍。考虑到Ang II在促进细胞纤维化、增强炎症反应中的额外作用,这一现象为揭示新冠病毒株及其诱导的病症之间的分子机制提供了新的理解。
该研究提供了从单分子层面阐明复杂体系多组分分子时序动态演化的新方法,揭示了RAS中ACE、ACE2之间的串扰效应。纳米孔道技术以其单分子、高通量、无标记的特征,在不引入额外干扰的情况下,可以“本征”地体现酶反应相互影响,开辟了纳米孔道单分子组学新方向。
海军军医大学长征医院韩焕兴主任共同参加了本课题的研究,课题受国家自然科学基金(批准号:22027806、21834001)的支持。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-023-01139-8