|
|
|
|
|
基于蛋白质水解靶向嵌合体(PROTAC)靶向策略,构建独特机制的抗巨细胞病毒活性模型 | MDPI IJMS |
|
|
论文标题:Development of a PROTAC-Based Targeting Strategy Provides a Mechanistically Unique Mode of Anti-Cytomegalovirus Activity(基于蛋白质水解靶向嵌合体(PROTAC)靶向策略,构建独特机制的抗巨细胞病毒活性模型)
期刊:IJMS
作者:Friedrich Hahn et al.
发表时间:27 November 2021
DOI:10.3390/ijms222312858
期刊链接:
https://www.mdpi.com/journal/ijms
微信链接:
https://mp.weixin.qq.com/s?__biz=MzI1MzEzNjgxMQ==&mid=2650051368&idx=2&sn=
b0d1be7edb8d817c7f68d2c725cc544a&chksm=f1d929ecc6aea0faa189f3ea02a51faa92
f202892d71c5ec1f26a96a792c6b4feaecfacc22f4&token=1910072809&lang=zh_CN#rd
人类巨细胞病毒 (Human Cytomegalovirus, HCMV) 是乙型疱疹病毒 (Betaherpesvirinae) 的原型种,是目前世界范围内主要流行的一种人体条件致病菌。在成年人群中,HCMV的阳性率为40%-95% [1]。尽管目前有一系列已批准的抗HCMV药物可用于预防和控制感染 [2-4],但这些药物都存在一定局限性,比如病毒耐药性和严重的药物副作用 [5,6]。因此,优化药物应用方案、开发新的靶向策略至关重要。
在Eric Sonntag等人之前的研究中,周期蛋白依赖性激酶 (CDK) 1、2 、7、9抑制剂以及广泛CDK抑制化合物在体外和体内都显示出非常显著的抗HCMV的活性以及潜在的广谱抗病毒活性 [7-14]。同时,近些年来,蛋白质降解靶向嵌合体技术 (PROteolysis TArgeting Chimera, PROTAC) 成为热门技术。PROTAC是一种具有双功能的杂合小分子,通过合适的连接链将靶蛋白配体与E3泛素连接酶配体连接,多泛素化诱导,驱动靶蛋白进入蛋白酶体降解。
来自德国埃尔朗根-纽伦堡大学Manfred Marschall 教授团队在International Journal of Molecular Sciences (IJMS)上发表题为 "Development of a PROTAC-Based Targeting Strategy Provides a Mechanistically Unique Mode of Anti-Cytomegalovirus Activity" 的研究论文,将两者结合起来,使用THAL-SNS032这种商业化的CDK9的靶向药物应用在PROTAC技术,探究了PROTAC用于抗病毒功能的药物的可行性,为目前抗病毒药物的开发提供了新的方向。
研究过程
01 PROTAC介导的目标蛋白降解能力评估
为分析THAL-SNS032是否在原发人类成纤维细胞 (HFF) 中诱导其靶蛋白的降解,并确定CDK降解的动力学过程,作者在不同时间点用THAL-SNS032处理HFF (图1B),发现该药物可以诱导CDK2、7、9的降解,但无法诱导CDK1的降解 (图1C)。

图1. THAL-SNS032诱导HFF细胞中CDK的降解。(A) SNS032和THAL-SNS032的化学结构。(B) 在40分钟、2小时、6小时和24小时分别收集用100、10或1 nM的THAL-SNS032处理过的HFF细胞。在药物处理24小时后,去除和冲洗THAL-SNS032,收集去除后40分钟、2小时、6小时和24小时的细胞。(C) 用免疫印迹分析检测CDK的表达情况。
HCMV感染时,会诱导几种CDK复合物表达的上调或下调,以建立细胞内环境,称为假丝分裂,促进病毒复制。理论上,病毒诱导CDK上调,使HCMV感染的细胞对PROTAC产生一定程度的抗性。与未感染HFF相比,在较低浓度的THAL-SNS032处理中就观察到CDK水平的降低。在三天的HCMV复制期间,观察到持续的CDK水平的降低 (图2),从而证明PROTAC效应完全抵消了HCMV驱动的CDK上调。由于THAL-SNS032在感染后3小时已经影响其主要目标CDK9的蛋白水平,PROTAC策略在似乎在病毒感染中断中异常有效。

图2. THAL-SNS032在HCMV感染的HFF中能诱导CDK的降解。
02 THAL-SNS032和SNS032能抑制HCMV病毒在人成纤维细胞中的复制
作者使用表达绿色荧光蛋白 (GFP) 的重组病毒,在基于报告的HCMV多轮复制试验中对这两种化合物进行了测试。结果发现靶向药物THAL-SNS032比起非靶向药物SNS032的抗病毒活性高四倍,且前者在浓度低于0.1 μM时,能抑制病毒复制,且没有细胞毒性,说明该靶向药物对HCMV有抗病毒作用 (图3)。
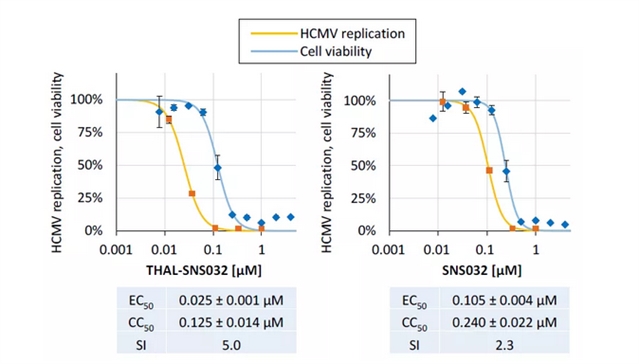
图3. THAL-SNS032和SNS032的抗HCMV活性分析。
03 THAL-SNS032与CDK7、 CDK8抑制剂的药物互作分析
由于一些CDK抑制剂在体外表现出很强的抗HCMV活性,例如CDK7的抑制剂LDC4297,因此作者假设同时抑制CDK9和CDK7可能会发挥非常强的抗病毒活性,从而降低有效剂量,减轻细胞毒性。为了在体外验证这种组合抗病毒药物的相互作用,作者进行了Loewe Additivity Fixed-Dose分析。结果发现THAL-SNS032和LDC4297联合使用总体上呈现出中度拮抗作用 (图4A,图4B),而与一种特异性靶向CDK8/19的抑制剂 (SEL120) 的联合使用中呈现中度协同作用 (图4C)。

图4. 用Loewe Additivity Fixed-Dose分析THAL-SNS032和LDC4297的药物相互作用。(A) 用指定浓度的THAL-SNS032和LDC4297处理HCMV AD169 -GFP感染的HFF,或作为单一复合处理,或作为两者的组合。相对于溶剂对照 (DMSO),通过定量复合处理细胞的细胞相关GFP荧光来确定病毒复制的抑制。(B) 生成的数据用于确定50%、75%、90%和95%病毒抑制时的CI值。随后,计算加权CI值 (CIwt) 为: (1 CI50 + 2 CI75 + 3 CI90 + 4 CI95)/10。(C) THAL-SNS032和CDK8抑制剂SEL120之间的药物作用分析,并计算相应的CI值和CIwt值。
04 THAL-SNS032在不同细胞类型中对不同HCMV病毒株的抗病毒作用
为进一步证实THAL-SNS032的抗HCMV活性,作者额外使用了两个感染完整HCMV Merlin病毒株的易感人类细胞系进行了系统的实验。当比较HCMV Merlin/TEV-1系统与HCMV AD169-GFP/HFF系统时,发现其抗病毒活性在相似的浓度范围内。然而,各自的CC50浓度明显不同,表明细胞毒性诱导在很大程度上取决于所使用的细胞类型 (图5)。
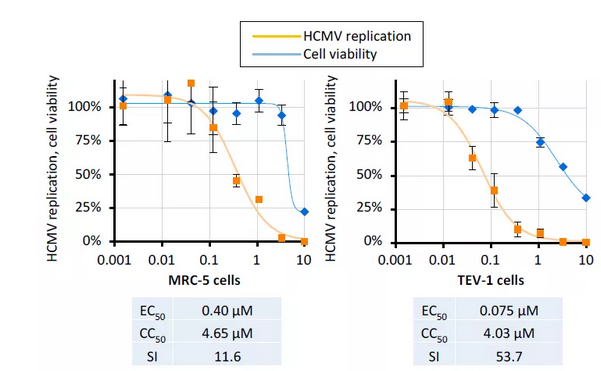
图5. THAL-SNS032抑制HCMV在MRC-5细胞和人妊娠早期绒毛外滋养层细胞 (TEV-1) 的复制。
05 THAL-SNS032和SNS032在体外具有相似的抗鼠巨细胞病毒 (MCMV) 活性
作者研究了THAL-SNS032和SNS032抗病毒能力在人和动物巨细胞病毒之间是否保守。与感染了HCMV的HFFs细胞相比,THAL-SNS032和SNS032对感染鼠类巨细胞病毒 (MCMV) 的EC50和CC50更高,且无论是否具有PROTAC的靶向片段,在鼠类复制模型中没有明显差异 (图6)。因此,在小鼠宿主细胞的环境中,THAL-SNS032显然像SNS032一样,作为一个普通的CDK9抑制剂,而没有靶标降解的优势。

图6. THAL-SNS032和SNS032抗MCMV的活性比较分析。
06 THAL-SNS032和SNS032能有效抑制SARS-CoV-2在人类细胞系中的复制
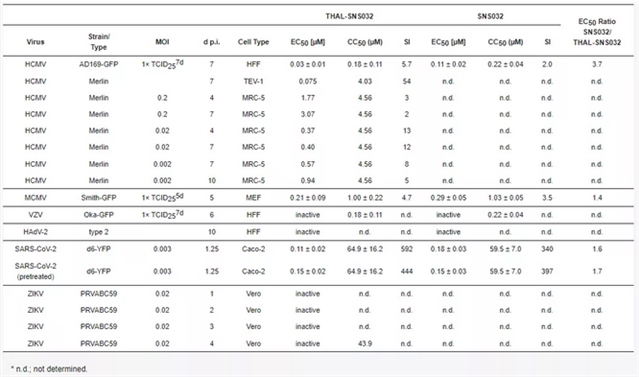
作者为了检测PROTAC的药物模型是否具有广谱抗病毒活性,分析了THAL-SNS032和SNS032对水痘带状疱疹病毒 (VZV)、腺病毒2型 (HAdV-2)、SARS-CoV-2以及寨卡病毒 (ZIKV) 的抗病毒作用。发现两者可以抑制SARS-CoV-2的复制,而对其他人类病毒则不敏感 (表1)。
表1. THAL-SNS032和SNS032在多种病毒复制模型中抗病毒活性的总结。
研究结论
该研究首次证明了运用PROTAC策略可以开发出具有强大抗病毒功效的药物。THAL-SNS032在非细胞毒性范围内显示了浓度依赖性的抗HCMV活性。此外,PROTAC-CDK9具有一定的广谱抗病毒活性。基于PROTAC的靶向特异性,为抗低保真度聚合酶驱动的病毒的药物研发提供了一个有价值的选择。
参考文献
1. Griffiths, P.; Baraniak, I.; Reeves, M. The pathogenesis of human cytomegalovirus. J Pathol 2015, 235, 288-297, doi:10.1002/path.4437.
2. Marty, F.M.; Ljungman, P.; Chemaly, R.F.; Maertens, J.; Dadwal, S.S.; Duarte, R.F.; Haider, S.; Ullmann, A.J.; Katayama, Y.; Brown, J.; et al. Letermovir Prophylaxis for Cytomegalovirus in Hematopoietic-Cell Transplantation. N Engl J Med 2017, 377, 2433-2444, doi:10.1056/NEJMoa1706640.
3. Gerna, G.; Lilleri, D.; Baldanti, F. An overview of letermovir: a cytomegalovirus prophylactic option. Expert Opin Pharmacother 2019, 20, 1429-1438, doi:10.1080/14656566.2019.1637418.
4. Marschall, M.; Stamminger, T.; Urban, A.; Wildum, S.; Ruebsamen-Schaeff, H.; Zimmermann, H.; Lischka, P. In vitro evaluation of the activities of the novel anticytomegalovirus compound AIC246 (letermovir) against herpesviruses and other human pathogenic viruses. Antimicrob Agents Chemother 2012, 56, 1135-1137, doi:10.1128/AAC.05908-11.
5. Britt, W.J.; Prichard, M.N. New therapies for human cytomegalovirus infections. Antiviral Res 2018, 159, 153-174, doi:10.1016/j.antiviral.2018.09.003.
6. Krishna, B.A.; Wills, M.R.; Sinclair, J.H. Advances in the treatment of cytomegalovirus. Br Med Bull 2019, 131, 5-17, doi:10.1093/bmb/ldz031.
7. Sonntag, E.; Hahn, F.; Bertzbach, L.D.; Seyler, L.; Wangen, C.; Muller, R.; Tannig, P.; Grau, B.; Baumann, M.; Zent, E.; et al. In vivo proof-of-concept for two experimental antiviral drugs, both directed to cellular targets, using a murine cytomegalovirus model. Antiviral Res 2019, 161, 63-69, doi:10.1016/j.antiviral.2018.11.008.
8. Sonntag, E.; Milbradt, J.; Svrlanska, A.; Strojan, H.; Hage, S.; Kraut, A.; Hesse, A.M.; Amin, B.; Sonnewald, U.; Coute, Y.; et al. Protein kinases responsible for the phosphorylation of the nuclear egress core complex of human cytomegalovirus. J Gen Virol 2017, 98, 2569-2581, doi:10.1099/jgv.0.000931.
9. Hutterer, C.; Hamilton, S.; Steingruber, M.; Zeittrager, I.; Bahsi, H.; Thuma, N.; Naing, Z.; Orfi, Z.; Orfi, L.; Socher, E.; et al. The chemical class of quinazoline compounds provides a core structure for the design of anticytomegaloviral kinase inhibitors. Antiviral Res 2016, 134, 130-143, doi:10.1016/j.antiviral.2016.08.005.
10. Graf, L.; Feichtinger, S.; Naing, Z.; Hutterer, C.; Milbradt, J.; Webel, R.; Wagner, S.; Scott, G.M.; Hamilton, S.T.; Rawlinson, W.D.; et al. New insight into the phosphorylation-regulated intranuclear localization of human cytomegalovirus pUL69 mediated by cyclin-dependent kinases (CDKs) and viral CDK orthologue pUL97. J Gen Virol 2016, 97, 144-151, doi:10.1099/jgv.0.000337.
11. Hutterer, C.; Eickhoff, J.; Milbradt, J.; Korn, K.; Zeittrager, I.; Bahsi, H.; Wagner, S.; Zischinsky, G.; Wolf, A.; Degenhart, C.; et al. A novel CDK7 inhibitor of the Pyrazolotriazine class exerts broad-spectrum antiviral activity at nanomolar concentrations. Antimicrob Agents Chemother 2015, 59, 2062-2071, doi:10.1128/AAC.04534-14.
12. Hutterer, C.; Wandinger, S.K.; Wagner, S.; Muller, R.; Stamminger, T.; Zeittrager, I.; Godl, K.; Baumgartner, R.; Strobl, S.; Marschall, M. Profiling of the kinome of cytomegalovirus-infected cells reveals the functional importance of host kinases Aurora A, ABL and AMPK. Antiviral Res 2013, 99, 139-148, doi:10.1016/j.antiviral.2013.04.017.
13. Feichtinger, S.; Stamminger, T.; Muller, R.; Graf, L.; Klebl, B.; Eickhoff, J.; Marschall, M. Recruitment of cyclin-dependent kinase 9 to nuclear compartments during cytomegalovirus late replication: importance of an interaction between viral pUL69 and cyclin T1. J Gen Virol 2011, 92, 1519-1531, doi:10.1099/vir.0.030494-0.
14. Rechter, S.; Scott, G.M.; Eickhoff, J.; Zielke, K.; Auerochs, S.; Muller, R.; Stamminger, T.; Rawlinson, W.D.; Marschall, M. Cyclin-dependent Kinases Phosphorylate the Cytomegalovirus RNA Export Protein pUL69 and Modulate Its Nuclear Localization and Activity. J Biol Chem 2009, 284, 8605-8613, doi:10.1074/jbc.M805693200.
IJMS 期刊介绍
主编:Maurizio Battino, Università Politecnica delle Marche, Italy
期刊发表生物化学与分子生物学、生物材料、生物物理、生物医学和化学等分子相关领域研究,已被Scopus、SCIE (Web of Science)、PubMed等数据库收录。
2020 Impact Factor:5.924
2020 CiteScore:6.0
Time to First Decision:16 Days
Time to Publication:34 Days


特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。