2021年12月13日,苏州大学刘庄教授、程亮教授团队与苏州大学附属第一人民医院介入科倪才方教授合作在Chem上发表了一篇题为“Nanoscale CaH2 Materials for Synergistic Hydrogen-Immune Cancer Therapy”的新研究。
课题组通过液相剥离技术制备了氢化钙纳米颗粒(nano-CaH2),并将其分散到低分子量聚乙二醇(PEG200)中,局部注射到小鼠肿瘤内,nano-CaH2遇水反应分解并原位产生氢气(H2)、钙离子(Ca2+)和氢氧根离子(OH−)等中和肿瘤弱酸性微环境、引发局部钙过载、实现氢气-免疫协同治疗。此外,纳米氢化钙联合临床用碘油(Lipiodol)栓塞剂,实现了兔子原位肝癌的氢气-栓塞联合治疗。
论文通讯作者是刘庄、程亮、倪才方教授;第一作者是巩飞、徐家晨、刘博、杨乃霖。
氢气(H2)作为一种内源性气体,具有显著的生理/病理调节功能。在过去十年中,氢气治疗在抗炎和抗肿瘤应用中的有效性已被证实,并且富氢水/富氢盐等氢气制剂已被用于炎症等疾病的临床实验。氢气抗癌的主要机制是氢气分子可以抑制癌细胞能量代谢、抑制血管内皮生长因子的表达以及激活系统免疫反应等。但是,目前常用的氢气递送策略例如富氢水(H2-water,口服)、富氢盐(H2-saline,静脉滴注)、富氢气(H2-gas,吸入)等很难达到局部治疗效果的阈值。因此,需要开发新型氢气递送策略来有效、可控并按需递送氢气。氢化钙(CaH2)材料作为一种便携式的氢源,可以高效地提供高纯氢气,为开发新一代氢气递送体系带来了契机。
近日,苏州大学刘庄教授、程亮教授团队通过液相剥离方法制备了氢化钙纳米颗粒(nano-CaH2),将其分散到低分子量聚乙二醇(PEG200)并局部注射到肿瘤内,nano-CaH2原位分解产生氢氧根离子(OH−)、钙离子(Ca2+)和氢气(H2)等中和肿瘤弱酸性微环境、引发局部钙过载、实现氢气-免疫协同治疗,有效地抑制小鼠肿瘤生长。该功能nano-CaH2可以有效抑制肿瘤生长的主要机制是:(1)产生OH−中和肿瘤弱酸性从而重塑免疫抑制微环境;(2)局部Ca2+增加会引发肿瘤钙过载和钙死亡;(3)释放H2触发氢气治疗和抗肿瘤免疫反应。此外,苏州大学附属第一人民医院介入科倪才方教授将nano-CaH2与临床用碘油(Lipiodol)栓塞剂复合制得氢化钙-碘油(nano-CaH2-Lipiodol)复合栓塞剂,有效地实现了兔子原位肝癌的氢气-栓塞联合治疗。
该论文中,作者通过液相剥离技术将大块状的CaH2固体粉末剥离成CaH2纳米颗粒,然后评估了nano-CaH2可以高效地释放H2、Ca2+和OH−。细胞实验发现nano-CaH2对肿瘤细胞(4T1和CT26)具有更高的毒性,可能的主要原因是OH−中和胞内弱酸性,局部Ca2+浓度增加引发钙过载和钙死亡,原位释放H2气体抑制线粒体功能并阻碍能量(ATP)合成,从而触发肿瘤细胞免疫原性死亡(图1-2)。
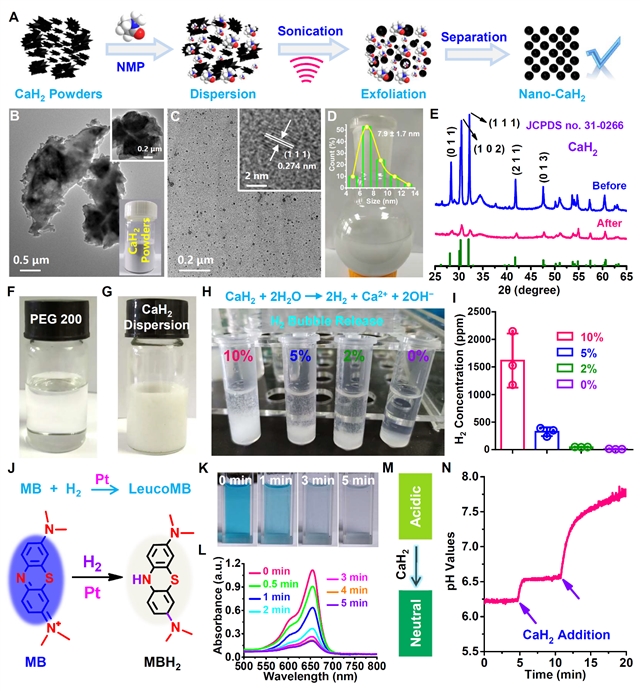
图1:nano-CaH2的制备与表征
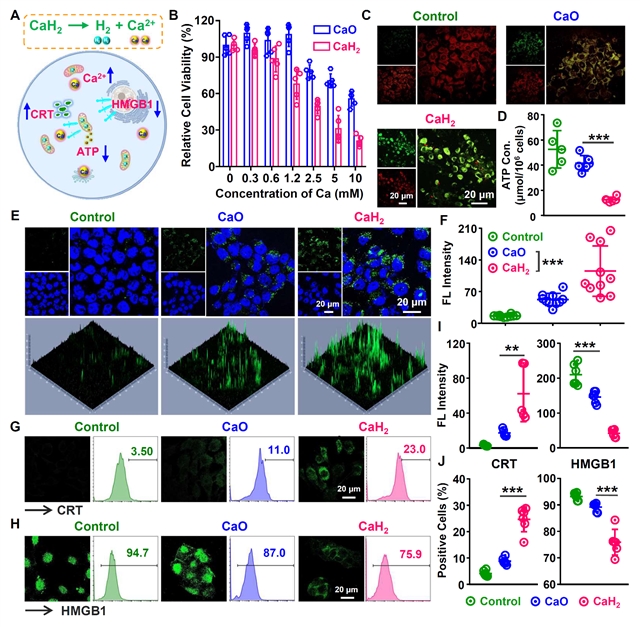
图2:nano-CaH2诱导肿瘤细胞免疫原性死亡(ICD)。
小鼠乳腺癌(4T1)和结肠癌(CT26)肿瘤模型均证实局部注射PEG200分散的nano-CaH2可以显著抑制肿瘤生长,延长小鼠的生存期,并且肿瘤的弱酸性被有效调节,瘤内的钙含量增加引起钙化,证实nano-CaH2在抗肿瘤治疗方面具有巨大的潜力。同时,作者研究发现,局部注射nano-CaH2产生的H2气体可以重塑肿瘤免疫抑制微环境,促进杀伤性T细胞的浸润,同时联合免疫检查点抑制剂(aCTLA-4)可以进一步放大免疫治疗效果,对远端肿瘤也表现出很强的抑制效应,再次证明了nano-CaH2抗肿瘤治疗的潜力(图3-5)。

图3:nano-CaH2用于肿瘤联合治疗。
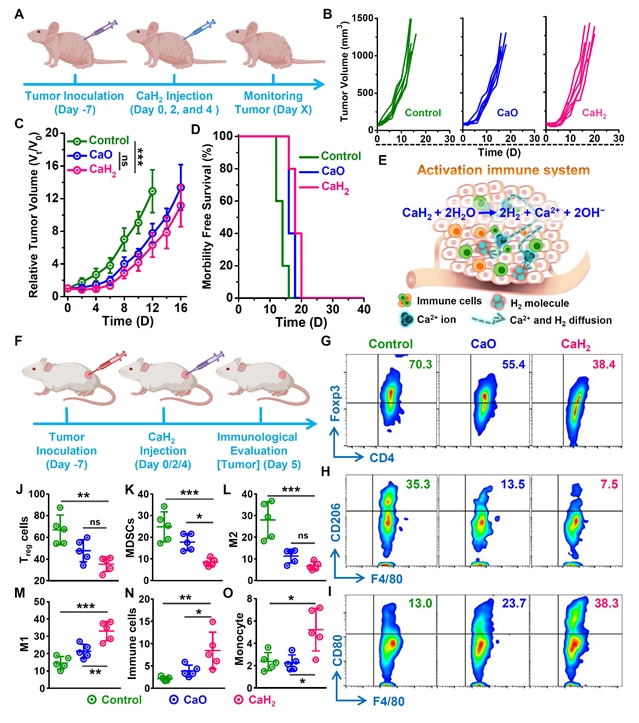
图4:nano-CaH2在活体水平诱导免疫应答

图5:nano-CaH2联合免疫检查点抑制剂(aCTLA-4)增效免疫治疗
由于动脉栓塞(TAE)所产生的酸性和免疫抑制肿瘤微环境是导致传统栓塞后肿瘤转移的主要原因,我们引入nano-CaH2可以有效地克服上述TAE的局限性。在兔子原位肝癌模型中,将nano-CaH2与碘油(Lipiodol)复合得到nano-CaH2-Lipiodol复合栓塞剂,通过介入技术将复合栓塞剂局部注射到肝肿瘤部位。随着碘油的沉积,nano-CaH2原位分解产生H2增强栓塞治疗,产生OH−调节酸性肿瘤微环境,从而放大氢气-栓塞-免疫联合治疗,显著提高中晚期肝癌的治疗效果(图6)。
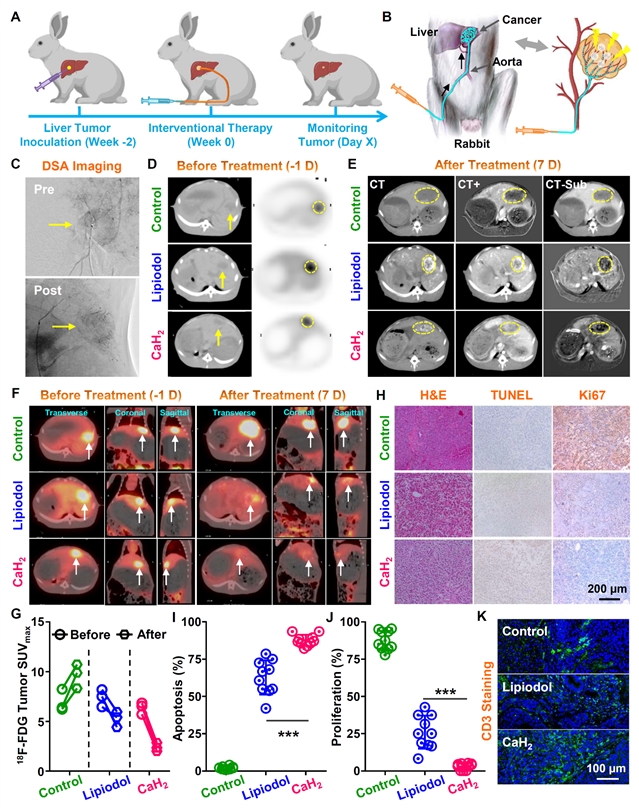
图6:nano-CaH2-Lipiodol复合栓塞剂用于兔原位肝癌介入栓塞治疗
(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.chempr.2021.11.020