近日,Journal of Experimental Biology 杂志刊登了厦门大学近海海洋环境科学国家重点实验室董云伟教授团队的重要研究成果“Heat-resistant cytosolic malate dehydrogenases (cMDHs) of thermophilic intertidal snails (genus Echinolittorina): protein underpinnings of tolerance to body temperatures reaching 55°C”。
研究团队以分布于高潮间带,具有高耐热性的两种滨螺为研究对象,通过生理生化学实验及计算机模拟手段,发现耐热的软体动物通过增强代谢关键酶的作用,避免了在高温条件下的解链;研究团队还提出,局部柔性的增长使得酶在低温条件下能够发挥其催化功能,同时能在极端高温条件下,起到稳定蛋白质的作用,确保了蛋白质功能的维持。这些发现对于查明环境温度对生物分布的影响及其机制,预测气候变暖的生态学效应将具有重要意义。
滨螺广泛分布于潮间带高潮区,是潮间带垂直分布区划分的标志性物种。塔结节滨螺(Echinolittorina malaccana)和粒结节滨螺(E. radiata)是我国岩相潮间带高潮区常见物种,其温度耐受上限高达 55-60°C。董云伟教授团队与美国斯坦福大学 George Somero 教授,以及华侨大学张光亚教授团队合作,进行了一系列研究,探索了高热耐受性滨螺在极端高温条件下,仍旧保持体内蛋白质微结构的完整、功能的维持的奥妙所在。

图1栖息于高潮间带的滨螺频繁遭受极端高温的胁迫
细胞质苹果酸脱氢酶(cMDH)广泛存在于生物体内,促进细胞质和细胞器代谢产物交换方面具有重要作用。研究团队采集了高潮间带 Echinolittorina 科的两种滨螺——能够耐受高达 55°C 极端高温的塔结节滨螺,以及热耐受性略逊色的粒结节滨螺。从滨螺体内分离出 cMDH 后,在 20-40°C 范围内测定了酶促动力学系数(即KMNADH),通过测定上述两种不同来源 cMDH 氨基酸序列,研究团队发现两个关键位点——肽链中的第 48 和 114 号位点。粒结节滨螺 cMDH 中这两个位点的丝氨酸(Ser),在塔结节滨螺 cMDH 中被更小得多的甘氨酸(Gly)所取代。在 42 和 57°C 下模拟了蛋白质的变性过程,获得其微结构在不同温度影响下的变化轨迹,发现塔结节滨螺 cMDH 在 57°C 极端高温下较粒结节滨螺 cMDH 更稳定的关键所在——具有更强的刚性(Rigidity),即结构的稳定性。另一方面,模拟的结果也指出,与酶功能相关的氨基酸区域,其柔性同样更强,局部柔性的增长使得酶在低温条件下能够发挥其催化功能,同时能在极端高温条件下,起到稳定蛋白质的作用,保护酶免受高温刺激而导致的失活。(来源:科学网)
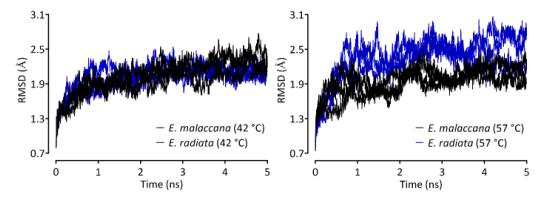
图2 极端高温下,热耐受性更强的塔结节滨螺具有更强的结构刚性(表现为更低的 RMSD 水平)。
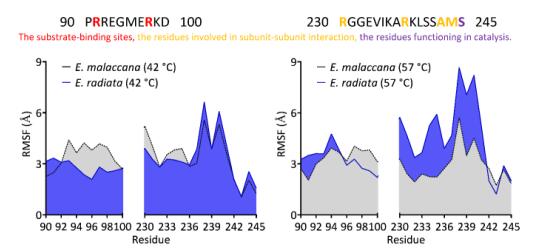
图3局部柔性的增长(表现为更高的RMSF水平)