中国科学院上海药物研究所研究员许叶春团队揭示了调控环鸟苷酸-腺苷酸合成酶(cGAS)的别构位点,并据此成功设计并优化获得了可阻止cGAS相分离的小分子抑制剂,系统阐明其作用机制和药理活性,该工作为cGAS抑制剂的发现开辟了新途径,也为靶向生物大分子相分离的药物研发提供了新方向。6月3日,相关研究结果发表于《自然-通讯》。
cGAS是感知胞质内异常DNA的关键模式识别受体,在结合DNA后被激活,催化合成环状第二信使cGAMP,cGAMP进一步激活STING而触发其下游信号传导,最终导致I型干扰素(IFN-I)反应。
cGAS-STING通路的过度活化与多种疾病的病理过程密切相关,开发高效、特异的cGAS抑制剂存在巨大临床需求,但现有cGAS抑制剂通常在种属选择性、细胞效力等方面受限。
研究团队在解析鼠源抑制剂RU.521与人源cGAS催化结构域复合物晶体结构时,发现RU.521的一个对映体作用于一个全新的位点。该位点邻近cGAS的“激活环”,RU.521与之结合能够锁定激活环的闭合构象,阻碍DNA结合而无法激活cGAS,因此研究团队将此位点命名为别构位点。
基于上述发现,研究团队从头设计并合成了能同时占据正构位点和别构位点的新型小分子抑制剂,其中代表性化合物为XL-3156和XL-3158。高分辨复合物晶体结构显示,XL-3156如同“蝴蝶双翼”般占据两个位点,并锁定激活环闭合构象。
详细的机制研究表明,这类别构抑制剂能够明显减弱cGAS与DNA的结合,直接抑制cGAS-DNA相分离凝聚体的形成,因而也被称为蛋白凝聚抑制剂(PCI)。在特定条件下,XL-3156将原本类似固体纤维状的“液-固相分离”(LSPS)凝聚体,转变为流动性更强的“液-液相分离”(LLPS)液滴,表明其显著降低cGAS-DNA相分离的程度。
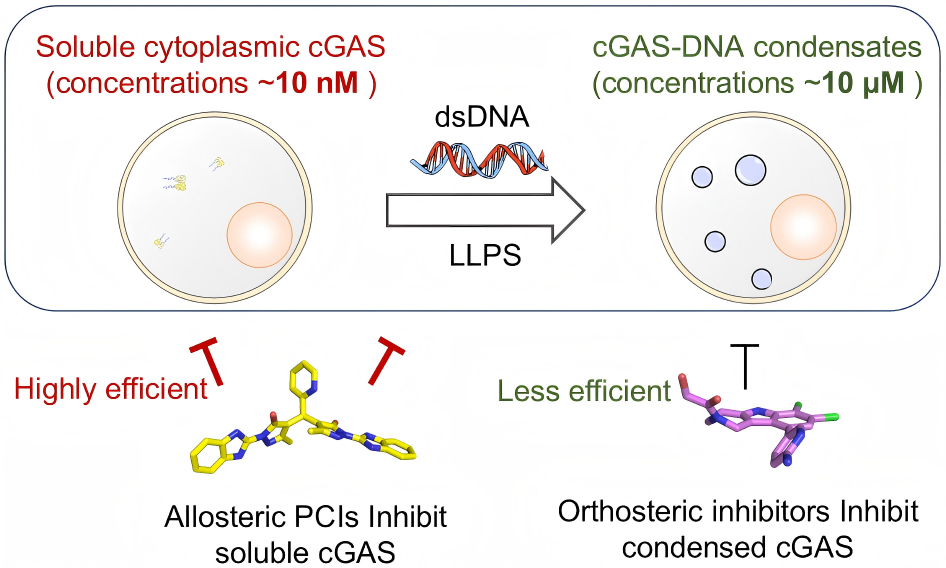 不同类型抑制剂的细胞效应示意图。图片由研究团队提供
不同类型抑制剂的细胞效应示意图。图片由研究团队提供
?
在此基础上,研究团队测试并发现了XL-3158与经典正构抑制剂G150联用具有显著的协同抑制效应,表明XL-3158能够阻止凝聚体形成,G150则可高效抑制游离cGAS。
值得一提的是,XL-3158对鼠源cGAS也表现出良好活性。在雨蛙素诱导的急性胰腺炎小鼠模型中的实验表明,口服XL-3158显著减轻了胰腺损伤,并降低了血清淀粉酶、脂肪酶活性及促炎因子TNF-α和IL-6水平,显示了该类抑制剂的体内抗炎活性及治疗潜力。
相关论文信息:https://doi.org/10.1038/s41467-025-60297-0
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。