3月27日,《自然》在线发表了中山大学附属第一医院(以下简称中山一院)研究员王骥团队联合复旦大学、辽宁大学相关科研团队的最新成果。他们提出了全新的疫苗佐剂设计思路,开发出全球首个具有引导抗原靶向内质网功能的新型疫苗佐剂SABER,为疫苗研发开辟了新路径。
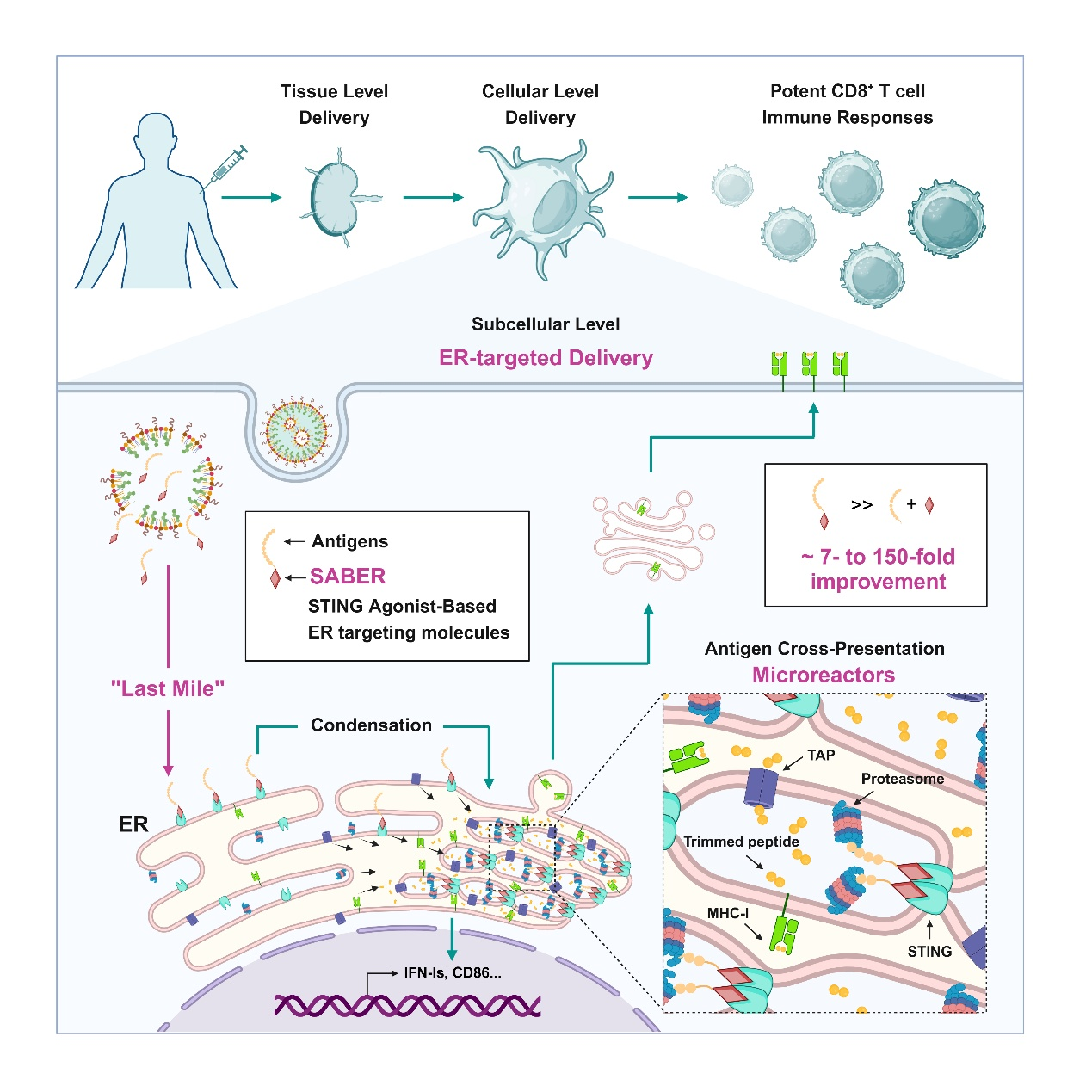
“与传统佐剂不同,SABER具有双重功能。”论文通讯作者王骥向《中国科学报》介绍,一方面,它能将抗原靶向内质网,加速抗原交叉递呈;另一方面,可通过激活干扰素刺激基因(STING)蛋白激活抗原递呈细胞,从而显著提升疫苗诱导表达CD8的T细胞(CD8+ T细胞)免疫反应的能力,为未来疫苗研发搭建了全新的技术平台。
该技术已获国家发明专利授权。《自然》杂志审稿人对这一双功能佐剂分子给予了高度评价,认为它“是一个创新概念,非常有趣并很有前景,有临床转化的可能性”。
 成果发表于《自然》。
成果发表于《自然》。
?
疫苗领域的“最后一公里”
疫苗作为传染病最经济有效的防治措施,以及肿瘤、自身免疫病等慢病极具潜力的治疗手段,一直备受关注。然而,当前传染病疫苗应对病原体变异能力较弱,病原体突变后效果大打折扣。CD8+ T细胞是杀伤肿瘤的主力军,在肿瘤疫苗中,诱导其免疫反应至关重要。
2020年,王骥团队在《科学》上发表的研究表明,通过诱导强有力的CD8+ T细胞免疫反应可以增强疫苗防护突变病原体的能力。但CD8+ T细胞免疫反应诱导不足,一直是疫苗领域的难题之一。
王骥指出,CD8+ T细胞免疫反应的诱导一直是疫苗领域的重大挑战,其核心难点在于抗原交叉递呈过程的复杂性与低效性。交叉递呈主要发生在树突状细胞(DC)中,需经历抗原从细胞外被摄取、转运至细胞质、最终抵达内质网并装载到MHC-I分子上的一系列步骤。
尽管以往研究多聚焦于如何增强抗原跨越细胞膜进入细胞质,并多种新型佐剂和递送系统,部分提升了CD8+ T细胞免疫反应的诱导效果,但抗原从细胞质到内质网的“最后一公里”仍是效率提升的关键瓶颈。
如何突破这一瓶颈呢?2018年从哈佛大学医学院回国的王骥在心底思索着:“这个问题还得从交叉递程本身的过程去探索优化。”王骥自清华大学本科毕业设计起,十几年间一直在从事疫苗研究,不断探索疫苗领域的关键问题。
在传统的疫苗中,抗原进入细胞后如“无头苍蝇”般散乱在细胞质各处,无法有效富集到内质网附近,抗原进入细胞质后到达内质网的“最后一公里”是影响交叉递呈的关键限速步骤。因此,找到一个能将抗原精准递送到内质网的“导航仪”至关重要,这需要免疫学、化学、材料科学等多学科的协同创新。
 王骥团队合影。
王骥团队合影。
?
为了突破这一难题,王骥组建了一支多学科交叉的研究团队,毕业于北京大学的化学博士王夏峰是团队的重要成员。团队成员经过一次次头脑风暴,逐渐有了思路:“或许可以利用能够结合内质网上蛋白的高亲和力小分子试试。”
基于多年来在STING研究中积累的经验,王骥判断内质网上的STING蛋白可能是突破口。将SABER与多肽偶联后,能够将多肽抗原直接靶向内质网,增强抗原交叉递呈,提升CD8+ T细胞免疫反应,还可以激活DC细胞。这是一个前所未有的双功能疫苗佐剂策略。
多学科团队攻坚,六年磨一剑
树突状细胞作为专业的抗原呈递细胞,负责捕获、加工抗原并呈递给CD8+ T细胞,启动特异性免疫应答,即抗原交叉递呈。该递呈过程是蛋白类疫苗诱导CD8+ T细胞免疫反应的主要途径,也是抗病毒、抗肿瘤的关键环节。
团队创新性地提出以位于内质网的跨膜蛋白STING为靶点,利用STING激动剂偶联抗原多肽,探索其是否能在激活STING的同时将抗原多肽精准递送至内质网。其中,王夏峰分析、改造和筛选了多个家族的STING激动剂,最终得到一类高亲和力的内质网靶向分子——SABER。
在研究过程中,体外细胞实验进展顺利,成功证实了SABER分子能够强化抗原交叉递呈功能,并促进CD8+ T细胞的增殖。但在随后的动物实验中,团队反复遭遇挑战。
“我们当时发现,寻找一个合适的体内递送策略极为困难。”论文共同第一作者、中山一院副研究员王夏峰表示。
 王夏峰在做化学合成实验。
王夏峰在做化学合成实验。
?
由于SABER-多肽偶联物的体积较大,导致其进入细胞的效率不高。王骥建议将偶联物封装于某些用于药物递送的载体材料中,以提升细胞层面的递送效率。然而,课题组缺乏合成载体材料的经验和相关设备。得知课题组的诉求后,医院很快为其专门购置了包载药物所需的微流控设备。
随后,研究团队投入了一年多的时间来探索实验条件,在动物实验中尝试不同的封装材料和配方,以检验其有效性。实验周期漫长,消耗大量的人力、物力和财力。实验复杂,需精心规划并实施,一旦发生错误,耗时数月的动物实验只能推倒重来。
尽管充满挑战,但团队成员紧密协作、互相鼓励,有计划、高效率地开展了系统性筛选测试工作,最终选定了安全有效的脂质纳米粒载体配方和工艺,并在动物实验中获得可稳定重复的阳性结果。
在研究中,团队证明了SABER可以提升CD8+ T细胞免疫反应,其能力优于现有主要佐剂5倍以上。在多种肿瘤和传染病疫苗动物模型中,SABER均展现了优异的预防和治疗效果。在肿瘤新抗原疫苗中,其效果显著强于临床研究中普遍采用的Poly I∶C佐剂,可有效治疗对免疫治疗抵抗的肿瘤。
而基于SABER技术的新冠病毒多肽疫苗可将变异毒株的病毒载量降低100倍。此外,SABER不但能够提升细胞免疫,还拥有与现有主要佐剂相当甚至更高的增强体液免疫反应的能力,可以有效增强交叉保护中和抗体的诱导。
 研究总结图。
研究总结图。
?
“该成果不仅实现了抗原的高效递送至内质网,还通过激活STING蛋白,聚集抗原加工所需的关键元件,大幅提升了抗原交叉递呈效率,将CD8+ T细胞免疫反应的诱导提升到了非常高的水平。”王骥表示,该成果为疫苗研发领域带来了新的思路与技术,有望进一步提升肿瘤疫苗疗效和传染病疫苗防护广谱性。
自项目启动实施以来,到向《自然》投稿,王骥团队耗费了整整五年时间。经过审稿过程中的反复修订,又经历了一年的努力,终于历经六载磨砺,铸就一剑。
“从分子合成到动物实验的成功,团队成员均倾注了全部心血,不懈追求。这是因为团队坚信,这一科学问题是有意义的,科学假说也是正确的,尽管过程中难免有曲折,但只要找到正确的路径,就必定能够抵达目标。”王夏峰说。
有望攻克疫苗效力难题
如果将疫苗比作一台精密的机器,那么佐剂就是这台机器的核心部件——芯片。先进的佐剂就像高性能芯片一样,能够为疫苗提供强大支持,使其在面对各种病原时都能发挥出最佳效果。
 王骥指导团队实验。本文由中山一院供图
王骥指导团队实验。本文由中山一院供图
?
王骥及其团队在疫苗研究领域深耕多年,始终聚焦于疫苗佐剂及递送系统精准递送技术,旨在有效激发高水平的CD8+ T细胞免疫反应,从而增强疫苗的效能和广谱性。在先前的研究中,包括王骥团队在内的众多学者,研究主要集中在抗原靶向组织及细胞层面的“宏观”递送策略上。
论文共同通讯作者、复旦大学研究员陆路指出,以往的研究仅限于将旅客送达旅游目的地的山脚下。然而,对于抗原向内质网递呈的“最后一公里”这一效率低下的过程,却鲜有人关注。这一过程已成为疫苗领域迫切需要解决的关键难题。
“SABER正是为突破疫苗效力所面临的重大瓶颈而设计的关键分子。SABER技术增强抗原交叉递呈功能,犹如通过缆车将旅客直接送达山顶,避免了复杂且劳累的爬山过程,实现了整个过程的迅速与高效。”陆路说。
该研究中,动物实验的阳性结果象征着转化为人类疫苗应用的潜在希望。王骥团队期望借助这一新型疫苗佐剂分子,革新疫苗技术平台,实现肿瘤及传染病疫苗的及时、便捷合成,并确保其应用的有效性和高效性。此次研究结果也体现了跨学科合作在创新领域所展现出的巨大潜力。
据介绍,SABER通过进一步优化后,有望能够在实际的临床应用中验证此新型疫苗佐剂策略。对于王骥而言,科研不仅是为了发论文,更要转化落地去解决临床上的实际问题,这也是中山一院一直以来做基础研究的初心。
作为国内规模最大、综合实力最强的医院之一,中山一院一直坚持“医病医身医心,救人救国救世”的医训,沉淀为中山医人的内核基因。“我们希望通过临床与基础研究的深度融合,为医疗领域带来技术进步。”王骥如是说。
相关论文信息:https://doi.org/10.1038/s41586-025-08758-w
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。