华南农业大学生命科学学院副教授胡宇飞课题组在国家自然科学重点基金等项目的资助下,在拟南芥中利用CRISPR/Cas9介导实现转移DNA(T-DNA)的高效定点插入,并开发出两种应用。近日,相关成果发表于《植物杂志》(Plant Journal)。
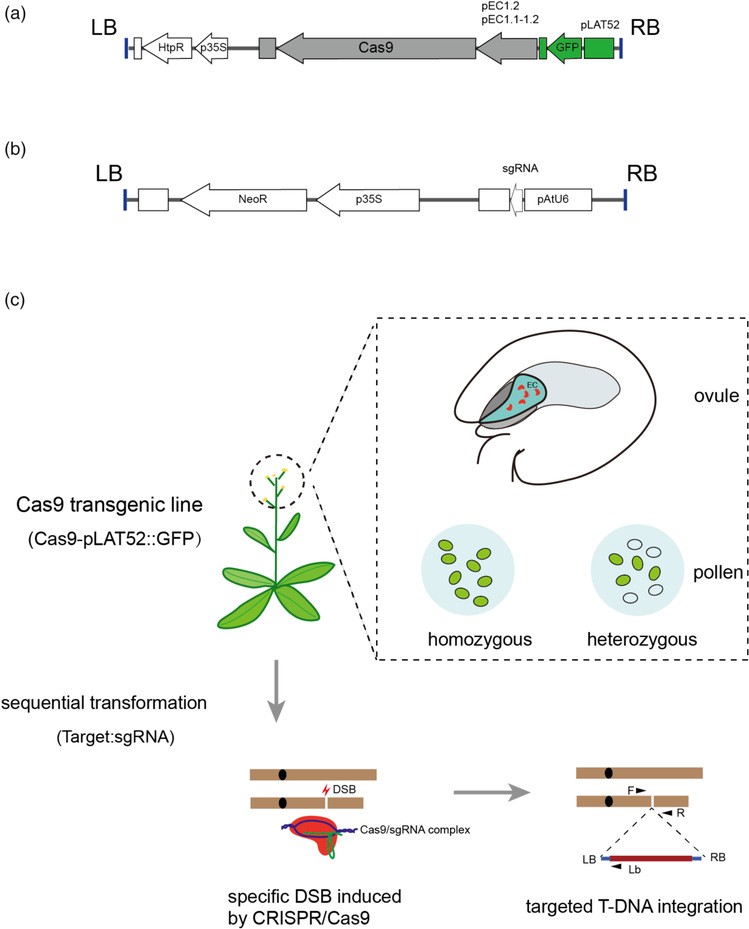 CRISPR/Cas9介导的T-DNA定点插入。研究团队供图
CRISPR/Cas9介导的T-DNA定点插入。研究团队供图
?
位点特异性DNA插入(site-specific DNA insertion)是作物育种和基因功能分析的重要工具,可以将功能性元件插入特定基因组位点,并可以避免插入基因在染色体不同位置所带来的表达差异。在过去几十年里,许多努力未能实现令人满意的效率。
传统的位点特异性DNA插入方法基于同源重组修复机制,然而,植物细胞中同源重组修复的低活性使得需要多个世代,筛选大量后代,因而低效。与同源重组修复介导的插入低效相比,农杆菌介导的T-DNA整合效率高,是植物遗传工程的主要手段。然而,T-DNA整合依赖非同源末端连接途径,在植物基因组中的插入位点具有随机性。
该研究开发了一种CRISPR/Cas9介导的拟南芥靶向T-DNA插入的方法。该方法比同源重组修复介导的方法更快速、高效,并以此开发了基因激活和雄性生殖细胞特异性基因标记两种应用。基因激活通过在T-DNA的LB端设置CaMV35S启动子,定点插入激活特定的下游基因。利用该技术实现了FT和MYB26的激活,显著增加了转录表达,分别导致早花和花药内壁次生壁增厚模式的改变。
雄性生殖细胞特异性基因标记的T-DNA中包含两个报告基因,即NeoR和MGH3::mCherry,有助于创建定点插入突变体,简化突变等位基因的遗传分析,并可对受精过程的生殖细胞进行活体追踪。该研究成功地将该系统应用于靶向精细胞特异表达,参与精卵识别的基因GEX2。
相关论文信息:https://doi.org/10.1111/tpj.70104
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。