内源性古病毒复活驱动开启衰老“潘多拉魔盒” 图源自论文
1月6日,中国科学院动物研究所研究员刘光慧课题组、研究员曲静课题组和中国科学院北京基因组研究所研究员张维绮课题组合作,在《细胞》杂志在线发表研究论文,该研究首次发现年轻的内源性逆转录病毒(Endogenous Retrovirus, ERV)亚家族在细胞衰老过程中可被再度唤醒,提出了古病毒复活介导衰老程序化及传染性的理论和阻断ERV古病毒复活扩散以实现延缓衰老的多维干预策略。
病毒与人类之间的协同进化关系源远流长。一方面,病毒使人类饱受疾病困扰甚至死亡,并在此过程中对人类基因组不断地利用与改造;另一方面,人类的免疫系统会积极对抗病毒的入侵,使得整合到人类基因组中的病毒序列逐渐被宿主细胞的遗传调控系统接管,协同进化。而ERV是数百万年前远古逆转录病毒入侵整合到人类基因组的遗迹——“古病毒化石”。在漫长的岁月里,大量ERV的遗传信息被人类细胞俘获,并经过突变、缺失等变异成为人类基因组中的“暗物质”潜伏下来,占据了人类基因组序列的8%左右,成为重要的基因记忆。
人类基因组中潜藏着诸多“老化”信号,这些衰老信息流通常受到表观遗传的严密调控而处于沉默状态,但在增龄过程中,由于表观遗传的失序,这些“老化”信号逃离管控,进而激活启动细胞内的一系列衰老程序。然而,占据人类基因组序列较大比例、如“死火山”般沉寂的ERV古病毒元件是否参与了衰老的程序化调控尚且未知。
利用团队建立的不同衰老研究体系、结合高通量链特异性转录本测序等多学科交叉技术,研究人员发现,衰老细胞中表观遗传去抑制(如异染色质减少)导致基因组中ERV的转录激活并翻译出病毒蛋白,进而包装成为病毒颗粒。一方面,衰老细胞中ERV的反转录产物通过激活cGAS-STING天然免疫通路诱发细胞衰老和炎症;另一方面,衰老细胞释放的ERV病毒颗粒可通过旁分泌或体液介导的方式在器官、组织、细胞间有效传递并放大衰老信号,最终使得年轻细胞因受“感染”而老化。
机制研究表明,ERV反转录产物在宿主细胞胞浆中的出现,会激活初始细胞及被感染细胞中固有的病毒防御机制。这种本能的细胞抗病毒反应意在降低病毒的损害,然而,恰恰是这些防御性机制促进了细胞的早衰。
论文第一作者、中科院动物研究所助理研究员刘晓倩介绍,“通过对ERV古病毒潜伏、复活、细胞间传递等不同生命周期环节的解析,我们开发出有效抑制ERV古病毒复活及清除病毒颗粒的干预策略,即通过发展基于靶向ERV调控元件的CRISPR基因沉默体系、靶向逆转录酶的小分子抑制药物、靶向病毒包膜蛋白的中和抗体等技术,阻断ERV的转录、反转录、病毒级联感染等多个环节,进而实现了组织和机体衰老的延缓。”
论文共同通讯作者张维绮表示,“研究系统定义并揭示了衰老诱导的内源性逆转录病毒复活(AIR-ERV)可以作为细胞、器官乃至机体衰老的驱动力及度量标志物,为衰老的程序化、级联放大和可干预性提供了全新的理论依据,为人类衰老的科学评估和预警、衰老及衰老相关疾病的防治提供了全新的线索和思路。”
“未来围绕着衰老伴随的ERV古病毒激活,将会涌现出更多的科学问题,例如:ERV古病毒序列在人类基因组中是否具有遗传多态性?ERV激活是否会选择性驱动特定衰老相关疾病的发生?体液中ERV检测能否应用于衰老和老年疾病的评估和预警?期待在科学研究不断深入和技术手段日益革新的将来,这些谜题可得以逐一解决。”论文共同通讯作者曲静说。
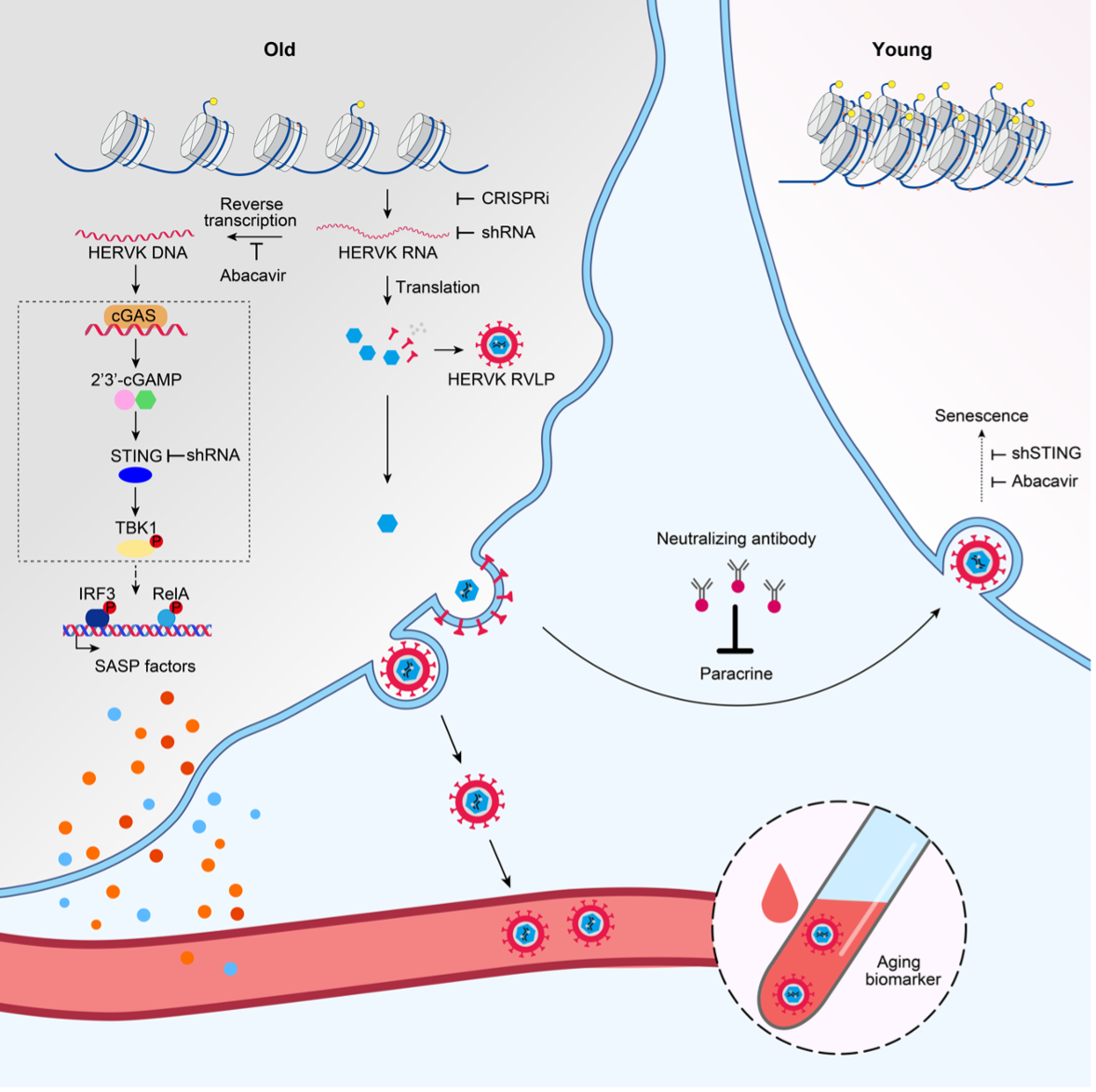
内源性古病毒复活驱动衰老的机制与干预策略 图源自论文
该论文的第一作者为中科院动物研究所助理研究员刘晓倩、博士生刘尊鹏、特别研究助理武泽明和中科院北京基因组研究所研究员任捷。
相关论文信息:
https://doi.org/10.1016/j.cell.2022.12.017
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。