|
|
|
|
|
噬菌体Pf4对囊性纤维化患者的呼吸道修复调控 | MDPI Viruses |
|
|
论文标题:The Inovirus Pf4 Triggers Antiviral Responses and Disrupts the Proliferation of Airway Basal Epithelial Cells
论文链接: www.mdpi.com/1999-4915/16/1/165
期刊名:Viruses
期刊主页:https://www.mdpi.com/journal/viruses
研究背景
囊性纤维化(Cystic Fibrosis, CF)是一种由CFTR基因突变引起的常染色体隐性遗传性疾病,患者常伴有慢性肺部感染,而铜绿假单胞菌(Pseudomonas aeruginosa, Pa)是其最常见的致病菌之一,慢性Pa感染与CF患者的肺功能下降与死亡率增加相关。近年研究发现,一种名为Pf4的丝状噬菌体(inovirus)在CF患者的呼吸道分泌物中大量存在。作为一种溶原性噬菌体,Pf4可在不裂解宿主菌的情况下持续释放,并参与细菌生物膜的形成,增强Pa的持续感染能力。然而,Pf4是否以及如何与宿主呼吸道细胞直接相互作用,尚不明确。近日,斯坦福大学肺生物学卓越中心转化研究副主任Carlos E. Milla教授团队在《Viruses》发表研究,针对相关问题开展了系统研究。
研究内容
假单胞菌噬菌体Pf4是一种基因组长度约为7–12kb的单链DNA病毒,它能以溶原状态整合于Pa基因组中,并持续释放0.8–2 μm的病毒颗粒,而不引起宿主菌裂解。气道基底细胞(Basal Cells, BCs)是气道生态系统的关键组成部分,存在于整个气道。研究表明,BCs能够分泌炎性物质,趋化因子和抗微生物物质以响应感染刺激,在气道的天然免疫中发挥作用。然而,在慢性Pa感染的CF患者气道中,高浓度Pf4噬菌体可通过改变BCs功能及引发异常抗病毒反应,加剧中性粒细胞浸润及组织损伤,进而导致感染慢性化与临床预后恶化。具体表现为,丝状噬菌体Pf4可被气道基底细胞识别为病毒并被内化(图 1),进而改变细胞对脂多糖的转录反应并影响其关键功能,同时激活TLR3介导的抗病毒应答,显著上调ISG15、IFIT3、OAS1等I型干扰素反应基因,并可诱导CXCL1、CXCL8和CXCL5等中性粒细胞趋化因子高表达(图 2)。该反应未在其他所用噬菌体中观察到,表明这一效应是Pf4特有的,而非噬菌体颗粒暴露的普遍特征。这一发现与先前关于病毒感知与中性粒细胞招募的研究一致:在呼吸道病毒感染期间,所有主要中性粒细胞趋化因子均被大量产生,中性粒细胞向感染部位的浸润强烈且持续,促进中性粒细胞聚集,显著抑制基底细胞的迁移与增殖能力,进而延缓损伤修复进程。值得注意的是,CF患者来源细胞在Pf4刺激下表现出更强烈的抗病毒反应和更严重的功能损伤,提示CFTR基因突变可能加剧Pf4介导的病理效应。此外,Pf4还可直接抑制气道修复能力,其作用机制与病毒—细菌共感染的免疫干扰效应密切相关。
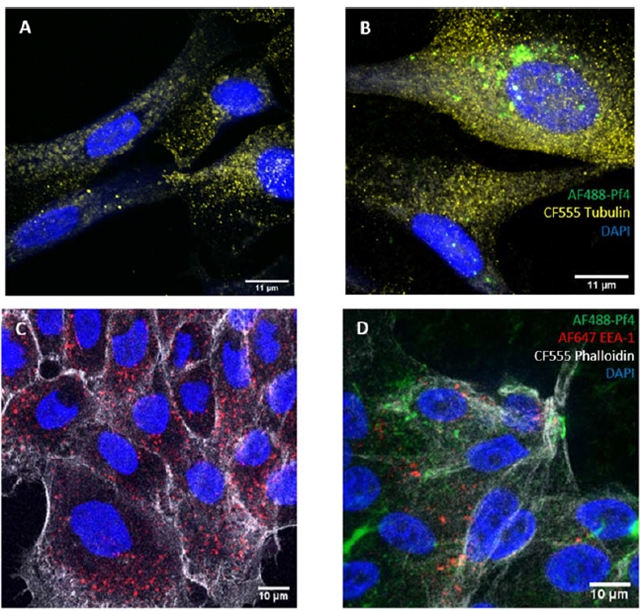
图1. CF BCs 内化 Pf4 噬菌体
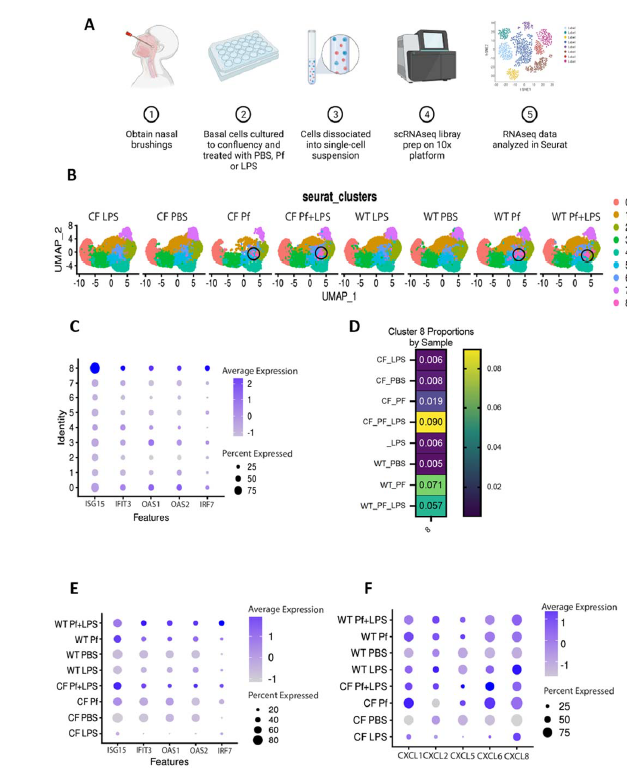
图2. RNA测序检测野生型(WT)和CF BCs单细胞对Pf4的不同反应
BCs在Pf4刺激下异常产生抗病毒因子和趋化因子的同时,其它细胞功能亦受到抑制。研究表明,Pf4的细胞内化及其所引发的免疫激活状态,会显著损害BCs的再生与修复功能,同时显著抑制BCs的细胞迁移、细胞运动调控及表皮分化,降低正常DNA代谢与有丝分裂的细胞比例。如在Pf4暴露下,与分化、复制和细胞迁移相关的细胞比例在对照组细胞(WT)中下降了约5–10%,在CF细胞中则下降了20–40%,表明Pf4暴露降低了WT和CF BCs的增殖/迁移速率(图 3)。同时Pa可能利用Pf4作为一种额外的致病工具,这或为一种先前未知的、参与CF气道中慢性Pa感染致病性的新机制。此外,CF患者的BCs本身即因CFTR功能缺失而存在修复能力下降,Pf4的叠加效应可能进一步削弱上皮屏障的完整性,延缓损伤后上皮再生,从而为细菌持续定植和炎症恶性循环提供条件。
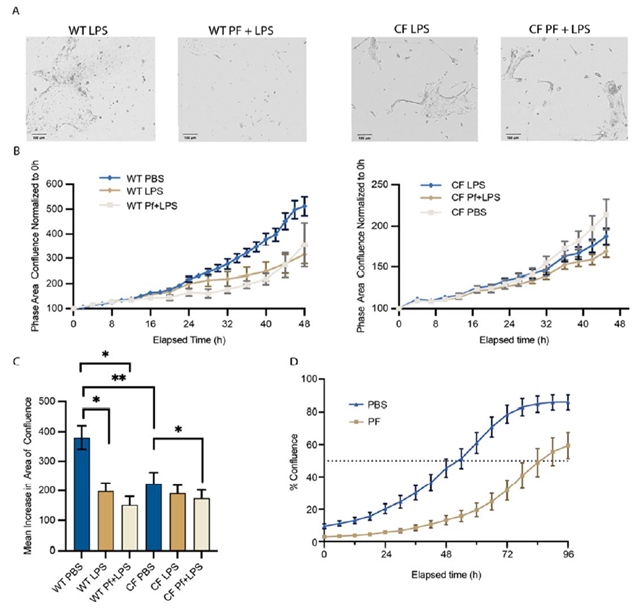
图3. Pf4抑制BCs迁移和增殖以阻碍细胞汇合
本研究首次表明丝状噬菌体Pf4可被气道基底细胞识别为病毒并被内化,进而改变细胞对LPS的转录反应并影响其关键功能。该发现揭示了一种先前未知的、参与CF气道中慢性Pa感染致病性的新机制,确立了Pf4作为一种新型毒力因子,不仅通过增强Pa生物膜稳定性间接促进感染持续,还可直接调控宿主干细胞功能与局部免疫微环境。这一机制为理解CF患者气道疾病进展提供了新视角,同时提示噬菌体疗法需谨慎评估其对宿主细胞的潜在免疫调节效应及功能干扰风险。
作者介绍
斯坦福大学肺生物学卓越中心研究副主任Carlos E. Milla教授为本文通讯作者,斯坦福大学传染病系博士Medeea C. Popescu和Naomi L. Haddock为本文共同一作,此外,Elizabeth B. Burgener、Laura Rojas-Hernandez、Gernot Kaber、Aviv Hargil以及Paul L. Bollyky(均来自斯坦福大学)也共同参与了本研究工作。该项目获得了美国国立卫生研究院(National Institutes of Health)及Ross Mossier CF研究实验室基金的资助。
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。