|
|
|
|
|
代谢综合征:概述与机制探讨 | MDPI Obesities |
|
|
原文链接:https://www.mdpi.com/2673-4168/4/3/20
论文标题:The Metabolic Syndrome: An Overview and Proposed Mechanisms
论文链接:https://doi.org/10.3390/obesities4030020
期刊名:Obesities
期刊主页:https://www.mdpi.com/journal/obesities
在 21 世纪,肥胖已然成为一项重大的公共健康挑战,随之而来的是代谢综合征(MetS)患病率的攀升。MetS 并非单一疾病,而是一组紧密关联的健康危险因素的集合,涵盖肥胖或腹部肥胖、2 型糖尿病(T2DM)、高血压(HTN)以及血脂异常等。发表于 MDPI 的Obesities期刊上的 “The Metabolic Syndrome: An Overview and Proposed Mechanisms” 一文,阐述了代谢综合征的诸多重要方面,旨在更清晰地理解代谢综合征的靶点,并阐明其复杂性及其下游效应。
代谢综合征的病理生理基础
MetS的核心病理改变涉及多系统、多器官的代谢紊乱。根据WHO标准,中心性肥胖(男性腰围≥102cm,女性≥88cm)合并以下任意两项即可诊断:高血压、糖代谢异常或非HDL胆固醇升高。其发病机制复杂,主要包括:
胰岛素抵抗:肥胖引起的脂肪组织重塑导致脂肪细胞肥大,释放大量游离脂肪酸(FFA),在肝脏和肌肉中沉积,干扰胰岛素信号传导。同时,炎症因子(如TNF-α、IL-6)通过激活JAK/STAT通路,促进IRS-1丝氨酸磷酸化,加重胰岛素抵抗。
慢性低度炎症:脂肪组织巨噬细胞极化失衡,M1型巨噬细胞主导引发炎症反应。NLRP3炎症小体激活后释放IL-1β和IL-18,进一步损害代谢稳态。
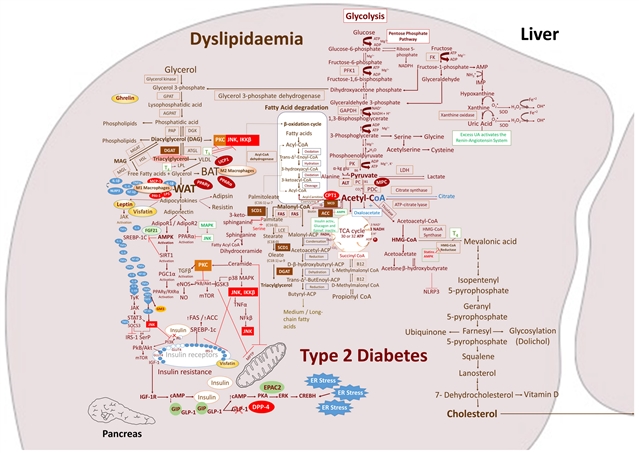
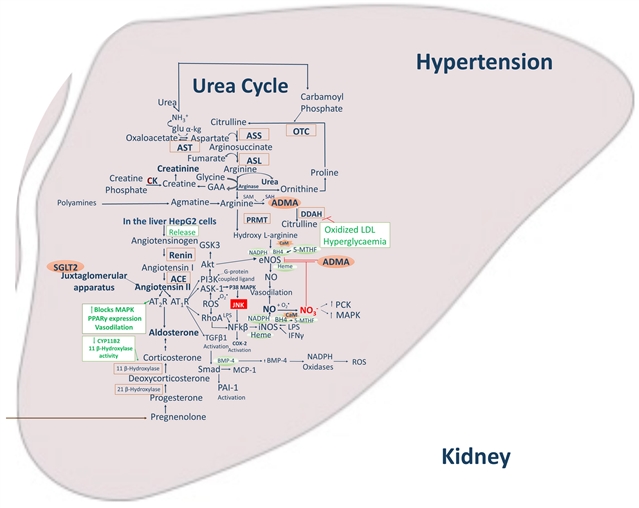
图 1. 代谢综合征示意图。该图是血脂异常、2 型糖尿病和高血压之间推测的代谢串扰的示意图。钝箭头 (┴) 表示抑制或阻断,尖箭头 (→) 表示刺激或关联。
能量代谢紊乱的关键环节
线粒体功能障碍:
过量营养摄入导致线粒体氧化磷酸化能力下降,ATP生成减少,ROS堆积。线粒体作为糖脂代谢的核心场所,其功能紊乱直接影响TCA循环和β-氧化过程。
铁死亡的作用:
新近研究发现,铁依赖性细胞死亡形式——铁死亡在MetS中起重要作用。铁过载和脂质过氧化通过抑制GPX4活性,加剧肝脏、脂肪等组织的细胞损伤。这一过程涉及:
1. 铁代谢异常:肥胖患者常伴铁过载,Fe2+通过Fenton反应产生大量ROS,导致脂质过氧化。
2. 抗氧化系统受损:GPX4活性下降,谷胱甘肽(GSH)耗竭,削弱细胞抗氧化能力。
3. 脂质代谢紊乱:多不饱和脂肪酸(PUFA)过氧化生成大量脂质ROS,诱发细胞死亡。
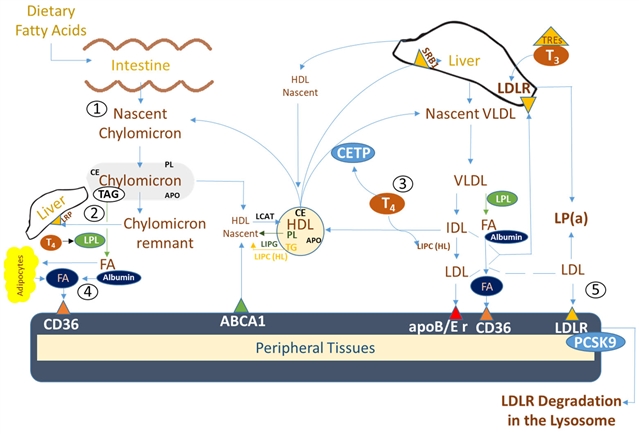
图 2. 脂蛋白和脂蛋白颗粒代谢的示意图:外源性或内源性途径。
各组分疾病的病理关联
2型糖尿病:
胰岛β细胞内质网应激是核心环节。高血糖迫使β细胞过度合成胰岛素,导致未折叠蛋白反应(UPR)持续激活,最终引发细胞凋亡。mTOR通路过度激活会抑制胰岛素信号传导,而DPP-4酶使肠促胰素(GLP-1、GIP)失活,进一步恶化糖代谢。
血脂异常:
LDL-C升高和HDL-C降低是主要特征。胆固醇酯转运蛋白(CETP)介导的脂质交换促进动脉粥样硬化。神经酰胺的积累通过激活PKC和NF-κB通路,加重胰岛素抵抗和血管损伤。
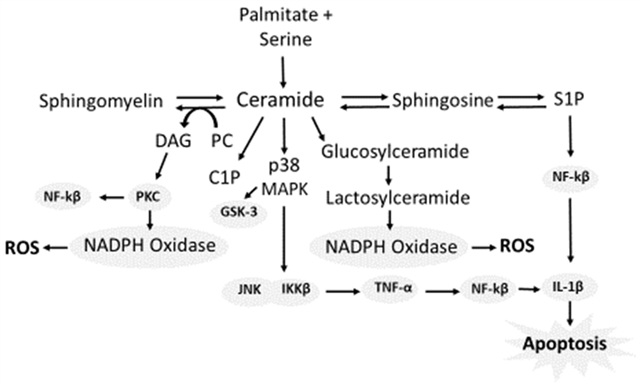
图 3. 神经酰胺的代谢。
高血压:
RAAS系统过度激活是关键。Ang II通过NADPH氧化酶增加ROS,同时精氨酸酶竞争性消耗L-精氨酸,减少NO生成,导致血管收缩。内皮素-1(ET-1)的过度表达进一步加重血管功能障碍。
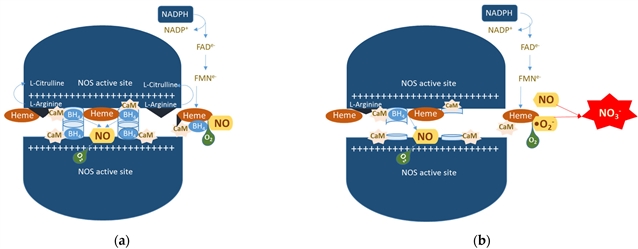
图 4. ( a )一氧化氮合酶偶联反应。( b ) 一氧化氮合酶解偶联反应。
结论
本综述系统梳理了代谢综合征的复杂机制,主要发现包括:
胰岛素抵抗和慢性炎症是MetS的核心病理基础
线粒体功能障碍和铁死亡是代谢紊乱的新机制
各组分疾病(糖尿病、血脂异常、高血压)存在共同的分子通路
脂肪组织作为内分泌器官,通过分泌脂肪因子参与全身代谢调控
未来研究需要进一步明确这些机制间的交互作用,为开发多靶点治疗策略提供依据。对现有代谢通路(如AMPK、PPARγ等)的深入理解,将有助于制定更精准的干预方案。
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。