|
|
|
|
|
QB 中国科学院大学袁莉和清华大学高军涛提出C-Nap1影响小鼠精子发生关键环节 |
|
|
论文标题:Single-cell analyses reveal impaired type B spermatogonia differentiation and meiotic entry in C-Nap1-null testes
期刊:Quantitative Biology
作者:Junlin Li, Liheng Yang, Liansheng Li, Min Li, Juntao Gao, Li Yuan
发表时间:26 November 2024
DOI:https://doi.org/10.1002/qub2.71
微信链接:点击此处阅读微信文章
在哺乳动物中,精子发生对于雄性生殖能力至关重要,该过程始于出生后并持续终生,其稳定性依赖于精原干细胞(SSCs)。SSCs位于睾丸生精上皮的基底部分,可分化为早期精原细胞,同时维持自身数量稳定。早期精原细胞经过一系列有丝分裂,最终分化为成熟精原细胞,其中B型精原细胞会进一步发育为前细线期精母细胞,最终形成成熟精子。
哺乳动物的中心体是主要的微管组织中心,由两个中心粒和周围的中心粒周物质组成。中心体连接蛋白C-Nap1定位在中心粒的近端,是所有连接蛋白的结合位点。在非转化的RPE1细胞中,C-Nap1 的缺失会导致中心体连接活性完全丧失,但对细胞迁移和高尔基体组织的影响较小。近期两项研究表明,C-Nap1敲除(KO)的雄性小鼠不育,但在某些表型特征上存在矛盾,且C-Nap1 KO小鼠精子发生缺陷的分子机制尚未得到充分探索。
近期,中国科学院大学袁莉和清华大学高军涛在Quantitative Biology期刊发表了一篇题为"Single-cell analyses reveal impaired type Bspermatogonia differentiation and meiotic entry inC-Nap1-null testes"的观点文章。本研究利用单细胞RNA测序技术分析野生型(WT)和C-Nap1 KO小鼠 10 日龄睾丸样本,旨在鉴定精母细胞和B型精原细胞中的差异表达基因,并通过基因本体(GO)富集分析评估相关通路,进而探究C-Nap1对精子发生的影响。

全文概要
本文通过构建C-Nap1基因敲除小鼠模型,运用单细胞RNA测序、生物信息学分析等多种实验技术,探究C-Nap1对精子发生的影响。研究发现,C-Nap1 缺失导致雄性小鼠不育,睾丸中精原细胞和精母细胞数量显著减少,生精小管出现空泡且附睾中无精子。进一步分析确定,C-Nap1缺失影响了B型精原细胞的分化和减数分裂起始,其可能通过影响 β-catenin 和 Aurka 等相关基因的表达来发挥作用。该研究证实C-Nap1是雄性小鼠精子发生的关键成分,为男性生殖研究提供了重要依据。
1.C-Nap1缺失导致精子生成障碍
研究团队首先利用CRISPR-Cas9技术构建了C-Nap1基因敲除小鼠,并通过基因组DNA PCR进行基因分型(图1A, B)。使用免疫荧光(IF)确认了C-Nap1 KO小鼠中C-Nap1表达的缺失。C-Nap1与中心体标记物γ-微管蛋白在C-Nap1+/+小鼠胚胎成纤维细胞(MEFs)中共定位,但在C-Nap1−/−小鼠中未观察到(图C)。值得注意的是,C-Nap1−/− MEFs中出现了两个广泛分离的γ-微管蛋白阳性点。在对C-Nap1小鼠的生育能力分析后,观察到C-Nap1−/−雄性小鼠没有产生后代,但C-Nap1−/−雌性小鼠产仔数量正常(图1D)。通过比较小鼠睾丸,C-Nap1−/−小鼠的睾丸重量与体重比减少了80%(1E, F)。成年C-Nap1−/−小鼠的组织学显示曲细精管中出现明显的空泡,附睾中没有精子。相反,成年WT小鼠的组织学显示曲细精管中没有空泡,附睾中有大量精子(图1G)。
通过测量两组小鼠在出生后不同时间的睾丸与体重比,发现12天时睾丸开始显示出统计学上的显著差异,但在12天之前没有统计学差异。睾丸组织学显示,C-Nap1−/−小鼠在出生后10天的精母细胞和精原细胞数量少于WT小鼠;此外,在12天和14天时,精母细胞和精原细胞数量也少于WT小鼠(图H, I, J),这表明C-Nap1缺失直接导致了无精症。
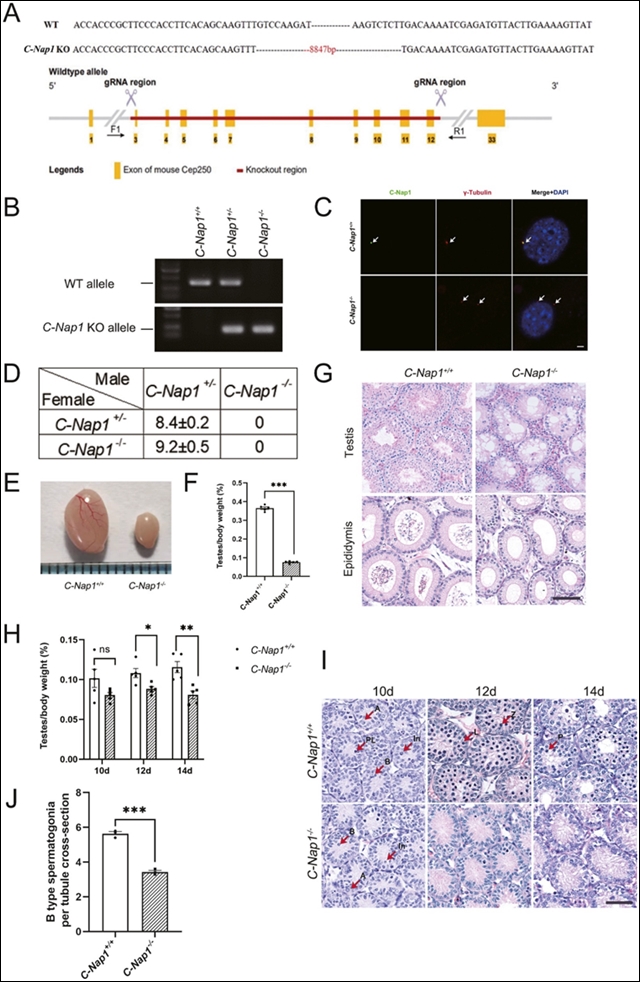
图1. C-Nap1缺失小鼠的精子生成缺陷。A图展示了C-Nap1基因敲除策略,B图通过基因组DNA PCR验证了敲除小鼠的基因型。C图通过免疫荧光实验显示C-Nap1在野生型(WT)小鼠的胚胎成纤维细胞(MEFs)中与γ-微管蛋白共定位,而在敲除小鼠中未检测到C-Nap1。D图显示C-Nap1-/-雄性小鼠完全不育,而雌性小鼠生育能力正常。E图和F图展示了C-Nap1-/-小鼠睾丸重量显著减少。G图通过组织学染色显示C-Nap1-/-小鼠睾丸中出现空泡且无精子。
2. 单细胞RNA测序分析揭示C-Nap1缺失睾丸中精母细胞减少
为了探索精子发生缺陷早期阶段的机制,研究团队进行了单细胞RNA测序,分析了WT和C-Nap1 KO小鼠的10天睾丸(图2A)。总共11,114个C-Nap1+/+和13,902个C-Nap1-/-睾丸细胞中,10,332个和13,308个细胞通过了质量控制。在单个细胞中检测到10,880个UMI(唯一分子指数)和3,526个基因,这些数据为区分小鼠睾丸中的每种细胞类型提供了合适的数据集。
通过UMAP聚类分析,研究人员鉴定了九种主要细胞类型,包括精原细胞、支持细胞、精原干细胞、间质细胞和精母细胞等(图2B)。在 C-Nap1 敲除小鼠中,精原细胞比例显著降低,精母细胞几乎消失。这一细胞比例的失衡,严重破坏了睾丸内正常的细胞生态,影响精子发育的微环境,从细胞层面揭示了精子发育受阻的原因。
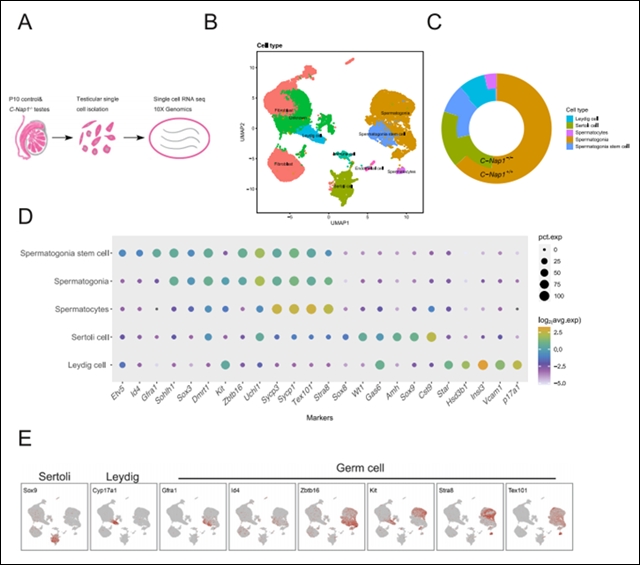
图 2. 小鼠C-Nap1基因敲除和野生型小鼠单细胞 RNA 测序获得的主要细胞类别和细胞特征概述。A图是研究流程示意图;B图为单细胞转录组数据的 UMAP 聚类分析可视化结果;C图展示了各细胞类型在野生型和敲除小鼠中的比例;D图通过点图展示了部分标记基因的表达;E图描绘了部分标记基因在 UMAP 图上的表达模式。
3. 单细胞调控网络分析
为了探索睾丸内不同细胞类型之间的细胞内通信模式以及与各种细胞发育相关的调控因子,采用了SCENIC(单细胞调控网络推断和聚类)作为计算方法,展示了支持细胞(Kif6、Sox9、Creb5和Mef2a)、间质细胞(Tbx1、Srebf2、Nr5a1、Cebpa、Esr1和Pbx1)、精原干细胞(Taf7、Egr4和Foxc2)、精原细胞(Cebpz和Foxf1)和精母细胞(Rfx3、Pparg、Pbx3、Nr5a1、Kdm5a、Smc3和Brca1)的调控因子(图3A)。其中,某些调控因子与精母细胞中的精子发育相关。例如,Brca1(图3B)是一个DNA损伤修复和交叉基因,已被证明在精子发生中起重要作用。同样,Pbx3是精母细胞的另一个特异性调控因子,被认为是小鼠精子发生中的重要转录因子。此外,多参数热图展示了基因表达水平以及功能注释和特征(图3C)。总之,这些数据提供了睾丸细胞发育和功能的分子机制的详细分析,重点是识别关键调控基因及其相互作用。
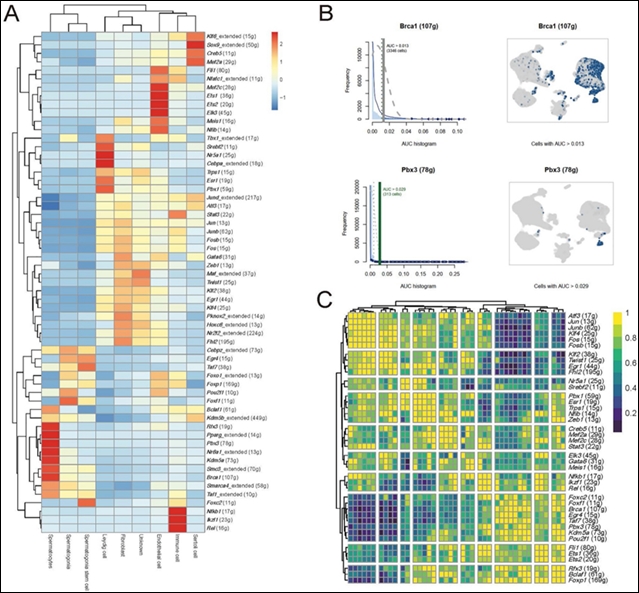
图 3. SCENIC转录组分析。A图展示不同基因标记在9种细胞类型中的表达水平聚类;B图结合AUC直方图和空间表达图展示Brca1和Pbx3的分布;C图为多参数热图。
4. C-Nap1 敲除改变睾丸转录组特征
虽然精母细胞是睾丸中细胞比例差异显著的细胞类型,但实验却在早期精原细胞中观察到C-Nap1+/+和C-Nap1−/−之间的差异。随后,对C-Nap1+/+和C-Nap1−/−的精原细胞进行了差异基因表达(DEG)分析,识别了93个差异表达基因(图4A)。GO分析显示,这些差异表达基因在与减数分裂过程相关的功能术语中富集,包括减数分裂细胞周期、核分裂、染色体分离、减数分裂I、精子细胞分化和染色体凝聚(图4B)。根据上述分析,在10天的C-Nap1+/+和C-Nap1−/−睾丸中进行了RT-PCR,显示KO组中许多减数分裂特异性基因显著下调(图4C),并通过免疫染色使用减数分裂特异性标记物SYCP3的抗体进行了验证(图4D)。
为了确定C-Nap1影响精子发生的具体阶段,重新聚类了2,806个C-Nap1+/+和2,391个C-Nap1−/−精原细胞。通过结合标记基因表达分布、UMAP和monocle3,鉴定出 5 种精原细胞亚型。C-Nap1+/+和C-Nap1−/−细胞在STAGE5亚型中的差异表达分析显示,已知在精子发生中起重要作用的Sycp1、Tex101和Top2a在突变STAGE5细胞中显著减少,且C-Nap1 敲除小鼠中 STAGE4 和 STAGE5 细胞比例显著下降,表明 C-Nap1 敲除影响了晚期精原细胞的发育,减少了 B 型精原细胞的数量。
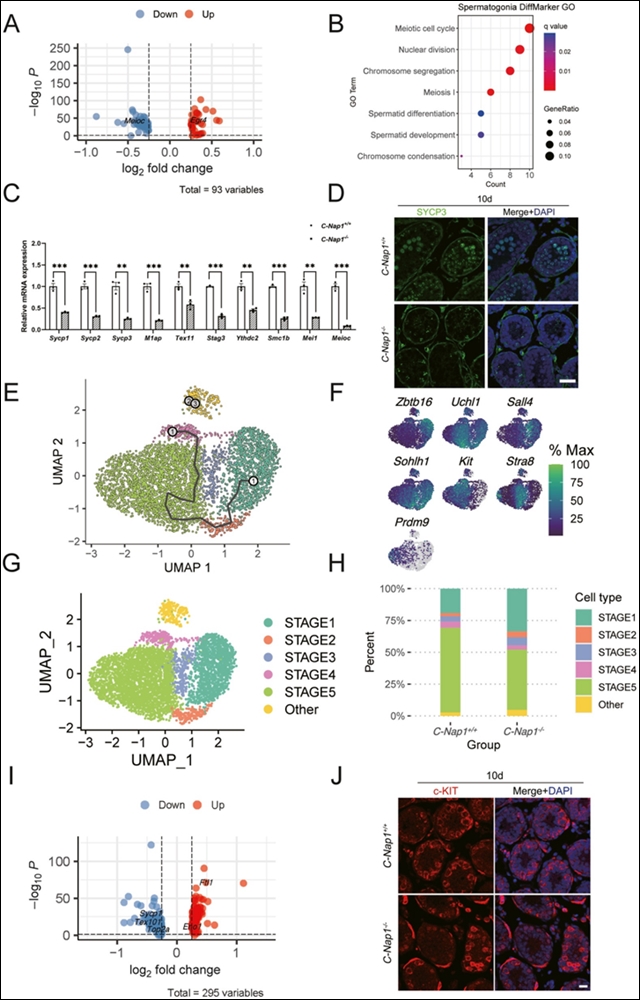
图 4. C-Nap1基因敲除导致小鼠精子发生的基因表达模式改变。A图为火山图展示差异表达基因;B图是基因本体术语与精原细胞差异标记图;C图为定量 RT-PCR 检测减数分裂特异性基因的 mRNA 表达;D图为免疫荧光分析减数分裂特异性标记 SYCP3;E图为结合伪时间排序和 UMAP 聚类的分析;F图展示了不同精原细胞状态下标记基因的表达模式;G图为精原细胞发育状态的 UMAP 图;H图为各精原细胞发育状态在不同基因型小鼠中的比例;I图为 STAGE5 中差异表达基因的火山图;J图为免疫荧光分析分化的精原细胞标记 c-KIT。
5. 高维加权基因共表达网络分析
为了探索与C-Nap1相关的基因在精子发生中的作用,研究团队采用高维加权基因共表达网络分析(hdWGCNA)对精原细胞进行进一步分析,获得了总共10个模块(图5A)。在评估每个模块在不同基因型和表达细胞类型中的表达水平后发现,棕色模块与精原细胞减少的细胞群体高度相关(图5B,C)。通过GO富集分析,棕色模块中的差异表达基因主要在与精子发生相关的功能术语中富集(图5D)。在比较模块后,假设棕色模块对应于图4G中的STAGE5。因此,使用STAGE5中的差异表达基因与棕色模块中的基因的交集作为代表KO小鼠表型效应的基因。
为了理解C-Nap1如何影响这些基因的表达水平,使用TRRUST数据库预测了这些基因的上游转录因子,并使用STRING数据库预测了与C-Nap1相关的蛋白质相互作用网络,随后选择了STAGE5中与这些蛋白质相关的差异表达基因,这些差异表达基因均显示出显著下调(图5E, F),因此推测这种下调可能是由于C-Nap1的缺失,从而影响了精子发生。
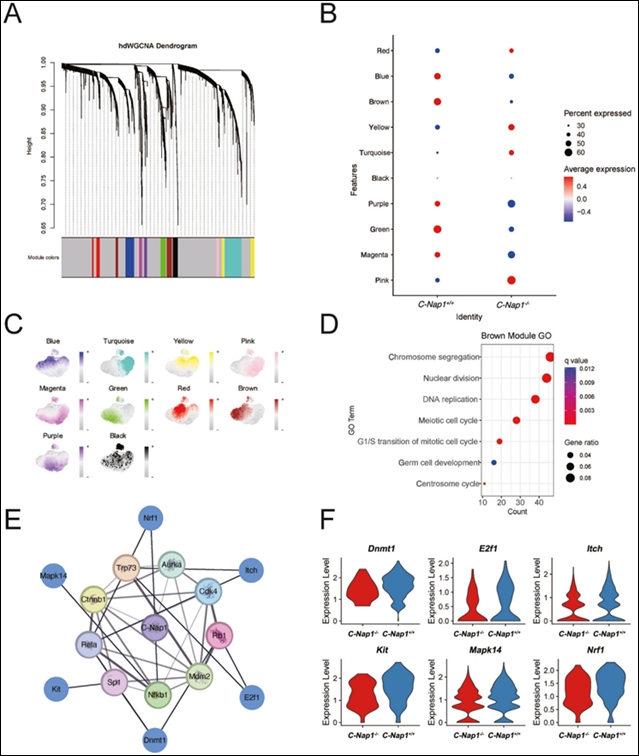
图 5. 高维加权基因共表达网络分析。A图为树状图及网络模块;B图展示了模块特异性基因表达水平;C图为模块间的聚类树;D图为棕色模块标记基因的基因本体术语;E图为以 C-Nap1 为中心的蛋白质网络;F图为 6 种基因标记的表达水平小提琴图。
6. 讨论
在精子发生的稳态过程中存在多个关键转变,如从未分化精原细胞到A1型分化精原细胞,以及从B型分化精原细胞到准备进入减数分裂的前细线期精母细胞的转变。本研究证实C-Nap1对精子发生至关重要,其缺失会导致雄性不育。近期其他研究也有类似发现,都表明C-Nap1缺乏会引起中心体分裂,有研究认为这会激活减数分裂停滞。本研究通过单细胞RNA测序分析10日龄野生型和C-Nap1基因敲除小鼠睾丸内的单个细胞,解析RNA转录本的异质性和复杂性。研究发现,支持细胞和间质细胞未受显著影响,这与之前的报告相符;但精原细胞和精母细胞显著减少,且分化的精原细胞也减少,不过精原干细胞未受影响。此前研究对C-Nap1影响精子发生的具体时间和细胞类型存在争议,本研究通过进一步分析确定,C-Nap1基因敲除影响精原细胞分化和随后生殖细胞从有丝分裂到减数分裂的转变。
基于STAGE5的差异表达基因,研究预测了一些可能与之相关的上游转录因子,其中β-catenin(由 Ctnnb1 编码)和Aurka可能与C-Nap1直接相互作用。第一种可能是,β-catenin与转录共激活因子TCF/Lef-1形成复合物在细胞核中发挥作用,且它与 C-Nap1 部分共定位,C-Nap1 缺失可能导致Rootletin和β-catenin从中心体间连接区域丢失,进而下调相关基因,但这是否是B型精原细胞减少的原因尚待研究。另一种可能是,Aurka在中心体和纺锤体纤维中发挥关键作用,影响生殖细胞发育,C-Nap1缺失可能影响Aurka的表达,从而影响晚期精原细胞的发育。总体而言,C-Nap1在精子发生中作用关键,但其调控的具体机制仍需深入探究。
总之,本项研究表明中心体蛋白C-Nap1是雄性小鼠精子发生的重要组成部分,C-Nap1是精原细胞从有丝分裂到减数分裂转变的必要条件。C-Nap1的缺失会导致B型精原细胞的减少,但C-Nap1在这一过程中的调控机制需要进一步研究。此外,通过单细胞测序挖掘了与C-Nap1相关的蛋白质网络,并筛选出一些与精子发生过程中减数分裂相关的基因。对于广大科研工作者来说,这一成果为深入探究精子发生的分子机制提供了重要依据;对于受男性不育困扰的家庭而言,也让他们看到了未来攻克这一难题的希望。期待未来能有更多相关研究,为生命科学领域带来更多突破!
QB期刊介绍
Quantitative Biology (QB)期刊是由清华大学、北京大学、高教出版社联合创办的全英文学术期刊。QB主要刊登生物信息学、计算生物学、系统生物学、理论生物学和合成生物学的最新研究成果和前沿进展,并为生命科学与计算机、数学、物理等交叉研究领域打造一个学术水平高、可读性强、具有全球影响力的交叉学科期刊品牌。
《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中12种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。