|
|
|
|
|
双铁酶介导的氮杂环丁烷药效团的生物合成以及分子机制 |
|
|
近日,武汉大学陈文青课题组、张郑宇课题组与厦门大学王斌举课题组展开深度合作,在氮杂环丁烷(Azetidine)药效团的生物合成研究中取得重要突破,相关成果以“A two-metalloenzyme cascade constructs the azetidine-containing pharmacophore”为题,发表在2025年9月30日的Nature Chemistry期刊上。武汉大学陈文青教授、厦门大学王斌举教授与武汉大学张郑宇副教授为论文通讯作者,武汉大学博士后龚蓉、博士研究生瞿瑶与厦门大学博士后刘佳为共同第一作者。
非血红素双铁酶HDO家族(HO-like Diiron Oxidases and Oxygenases)是近年来受到广泛关注的一类金属酶。该家族能通过活化氧气生成多种含氧活性中间体,进而催化多种具有挑战性的氧化反应。与经典非血红素双铁酶家族(FDOs)相比,HDO家族在结构上具有显著特征:其双铁中心呈现超长间距,配位环境更为灵活多样,导致其反应过程中可能形成的活性中间体具有更高的多样性与不确定性。揭示HDO双铁酶家族的催化反应机制,对于认识铁酶对氧气的活化机制,探索酶环境对于催化反应的微观调控作用具有重要意义。
近日,武汉大学陈文青课题组、张郑宇课题组与厦门大学王斌举课题组展开深度合作,在氮杂环丁烷(Azetidine)药效团的生物合成研究中取得重要突破。研究团队证实L-异亮氨酸作为起始底物在蝶蛉依赖铁酶PolE和双铁酶PolF的顺序催化下,经历去饱和与C-N环化,形成最终产物聚肟酸(1)。其中,通过生化实验与结构生物学手段首次鉴定出PolF为HDO超家族的新成员,明确其催化功能,并结合多尺度理论模拟方法(包括分子动力学模拟MD,量子化学计算QM,量子化学-分子力学QM/MM计算)阐明了该双铁酶PolF催化氧气活化以及分子内C–N环化反应的新颖分子机制。
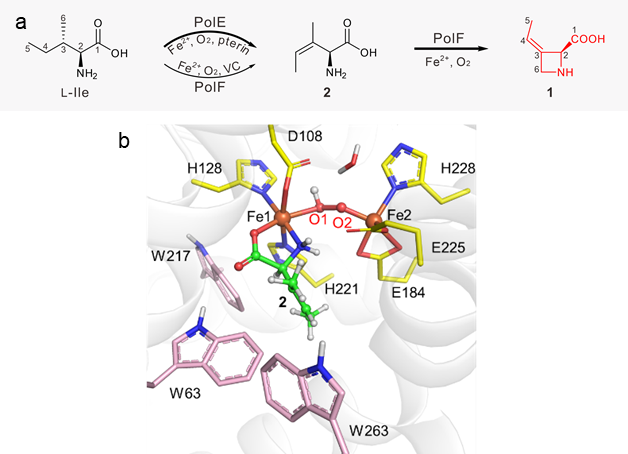
图1:a.聚肟酸的生物合成路径;b.去饱和异亮氨酸与PolF酶配位结构。
根据停流光谱实验结果,PolF酶中的双铁中心能够活化氧气,生成一种μ-过氧-Fe2(III/III)中间体(P物种)。基于量子力学(QM)计算的热力学分析表明,该P物种可从周围蛋白环境中接收一个质子,转化为Fe(III)Fe(III)-OOH物种。进一步的QM/MM计算揭示,在富含色氨酸的局部微环境中,距离底物最近的残基W63可向Fe(III)Fe(III)-OOH提供一个电子,促进其过氧键发生均裂,最终形成一种由色氨酸稳定的新型高价中间体(W辅助的X物种)。该X物种为首次报道,其发现进一步丰富了HDO家族中高价态中间体的结构与功能认知。
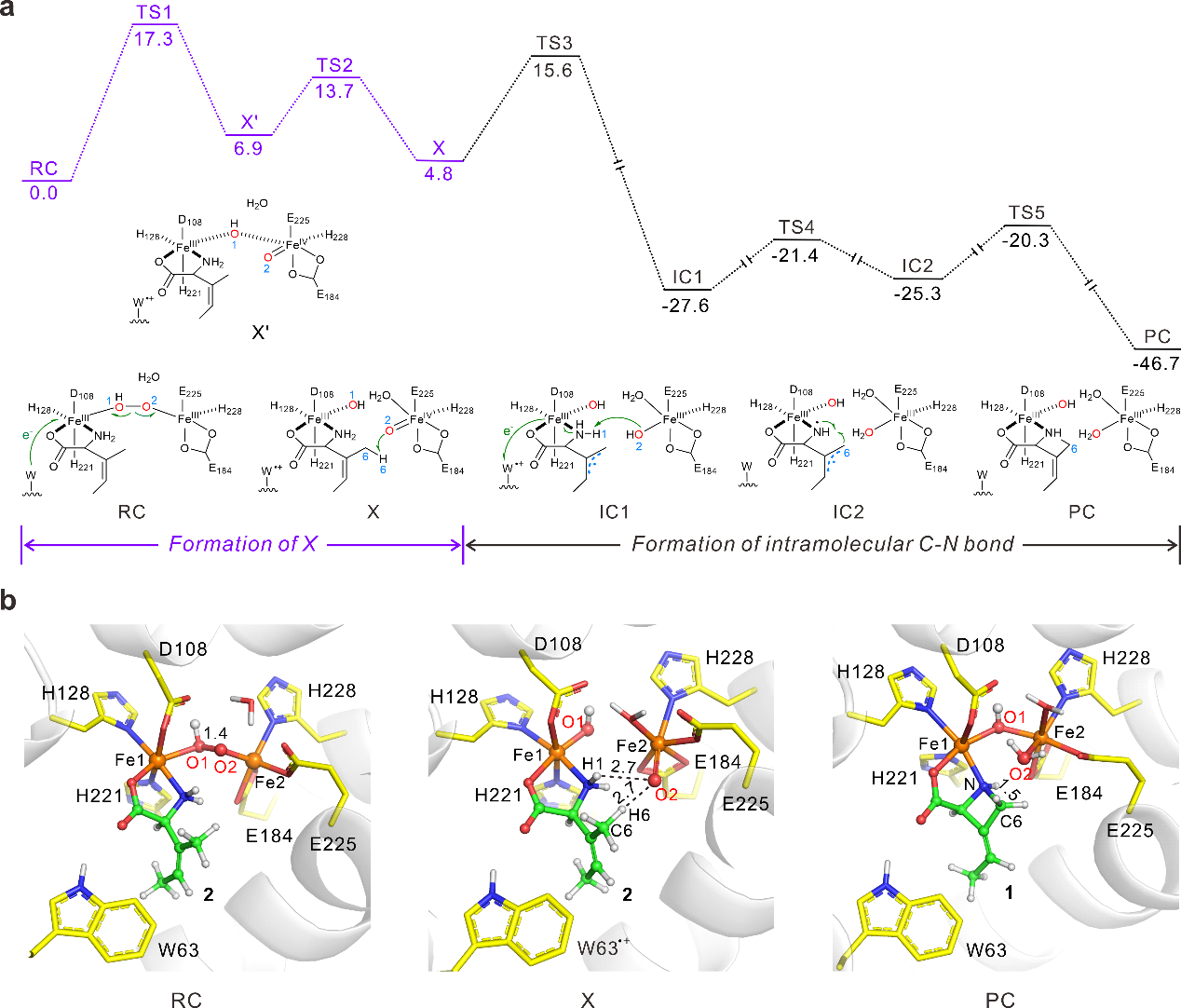
图2:PolF的催化机理研究。a.通过QM/MM计算获得的PolF催化底物2发生分子内环化反应生成产物1的势能面(kcal/mol);b. PolF催化底物2生成产物1的分子内环化反应中涉及的关键中间体结构。
在后续反应中,X物种中的高反应活性的FeIV=O可攫取底物C–H键,生成稳定的烯丙基自由基,随后,FeIII–OH活化底物N–H键,形成氮中心自由基,两者共同构成底物双自由基中间体。与此同时,W63自由基从双铁中心接收一个电子回归中性状态。最终,经双自由基耦合步骤完成C-N环化反应,生成目标氮杂四元环产物。当W63突变后,W217和W263亦可作为替代的电子供体辅助X物种生成,并通过突变实验得到了验证。
该研究通过实验探索与理论模拟的深度融合,不仅拓展了HDO超家族的催化反应边界,也解析了双铁酶催化氧气活化以及C-N环化的新颖分子机制。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-025-01949-y