|
|
|
|
|
铜催化环丙烷卤代物和端炔的立体汇聚式自由基交叉偶联反应 |
|
|
2024年9月26日,南方科技大学刘心元团队在Nature Synthesis期刊上发表了一篇题为“Copper-catalysed synthesis of chiral alkynyl cyclopropanes using enantioconvergent radical cross-coupling of cyclopropyl halides with terminal alkynes”的研究成果。
该成果报道了一种通用且高效的氧化还原态调控的铜催化策略,成功实现外消旋环丙烷卤代烃与末端炔烃的立体汇聚式自由基交叉偶联反应,构建了结构丰富多样的手性环丙烷化合物。
论文通讯作者是刘心元、顾强帅;第一作者是高增、刘霖。
手性环丙烷作为最小的全碳环,不仅广泛存在于天然产物、医药、农药、香料与材料中,而且作为重要的合成子应用于复杂分子与聚合物合成中,因此发展全新的策略实现该类分子的高效构建具有重要的研究意义。尽管该类单元当前已发展了多种合成方法,但利用廉价易得的外消旋环丙烷通过立体汇聚式的策略直接合成手性环丙烷的报道则相对较少,因此发展一种通用的催化体系实现多官能团取代手性环丙烷的高效构建,具有重要的研究意义和实际应用价值。
南方科技大学刘心元、顾强帅团队在自由基不对称催化领域开展了长期的深入研究,发展了一类铜/手性阴离子配体催化剂,可将外消旋烷基卤代烷通过单电子还原产生前手性的烷基自由基,然后与手性铜亲核试剂物种相互作用,从而实现自由基的立体控制(Nature 618, 294 (2023); Nat. Catal. 3, 539 (2020); 3, 401 (2020); Nat. Chem. 16, 466 (2024); 15, 395 (2023); 14, 949 (2022); 11, 1158 (2019); Nat. Synth. 2, 430 (2023))。在上述工作的基础上,刘心元团队设想通过组内发展的催化策略用以实现外消旋环丙烷卤代烃与末端炔烃的不对称自由基碳–碳交叉偶联反应,具体地,通过单电子还原可将外消旋环丙烷卤代烃转化为可快速翻转的环丙基自由基,随后该自由基与手性铜炔物种结合,实现高度对映选择性的C–C键偶联(图1b)。过渡金属催化的高活性烷基自由基的对映选择性交叉偶联反应经常面临严峻的化学选择性问题,主要是由于与闭壳反应物(closed-shell reactants)的副反应(图1a)。由于反应速率比ν1/ν2与烷基自由基浓度无关,因此通过降低烷基自由基浓度来抑制副反应的策略是无效的,调节化学选择性的唯一可能是通过调控Nu-Mn+1L*的浓度来增强目标反应,然而文献中对相关报道较少。由于环丙烷自由基比普通烷基自由基更具活性(C-H键解离能: PhC((CH2)2)–H, 93 kcal/mol; PhC(Me)–H, 85 kcal/mol),从而会导致许多副反应的发生,如氢原子转移(HAT)和对不饱和键的加成等。
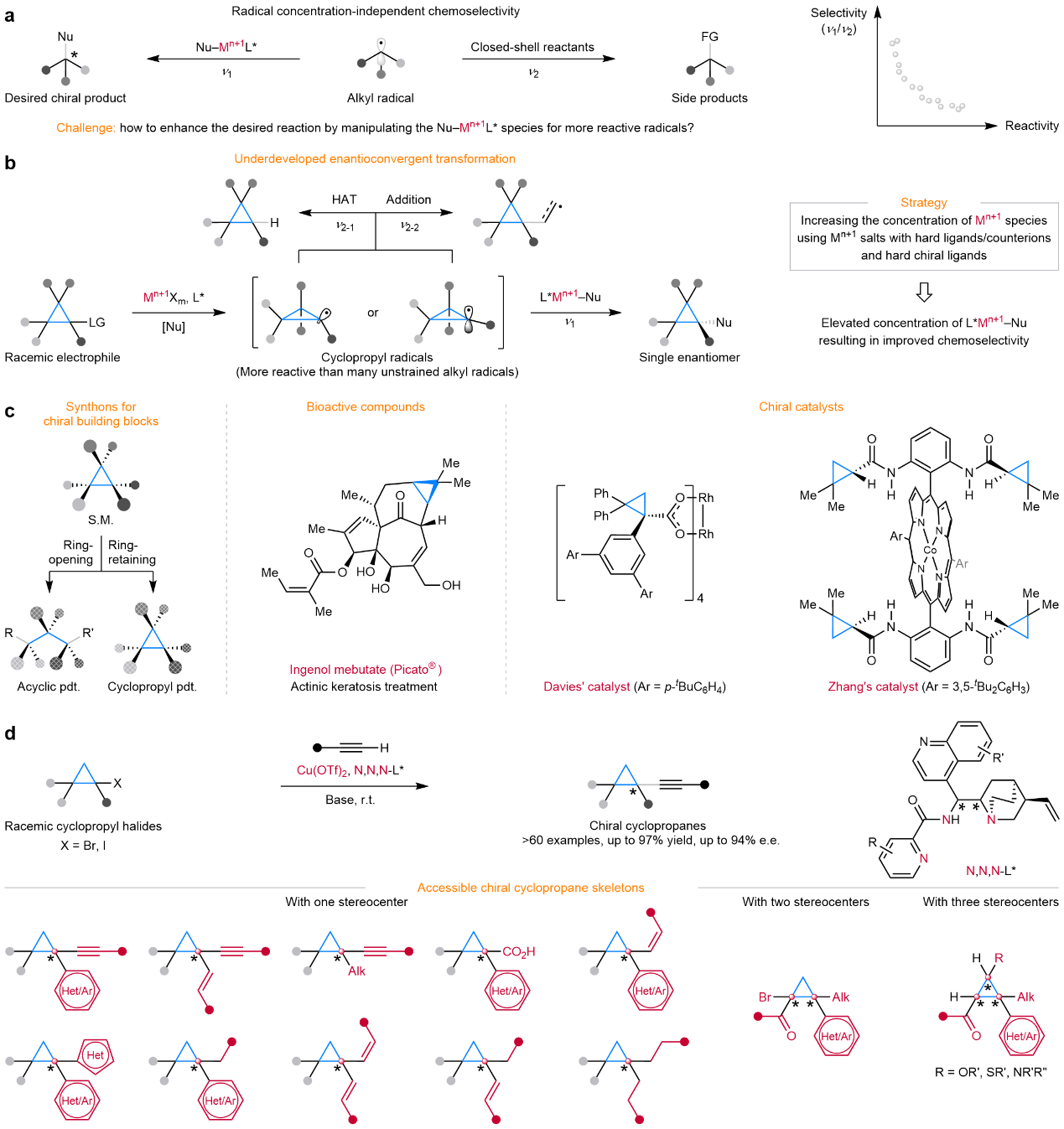
图1:研究背景和本文工作。
为应对这一挑战,作者提出了一种通用且高效的氧化还原态调控的铜催化策略,在温和条件下实现外消旋环丙烷卤代烃与末端炔烃的立体汇聚式自由基交叉偶联反应(图1c)。该方法关键是使用手性N,N,N-阴离子配体与Cu(II)盐的结合,通过提高Cu(II)物种的浓度,抑制副反应的发生。
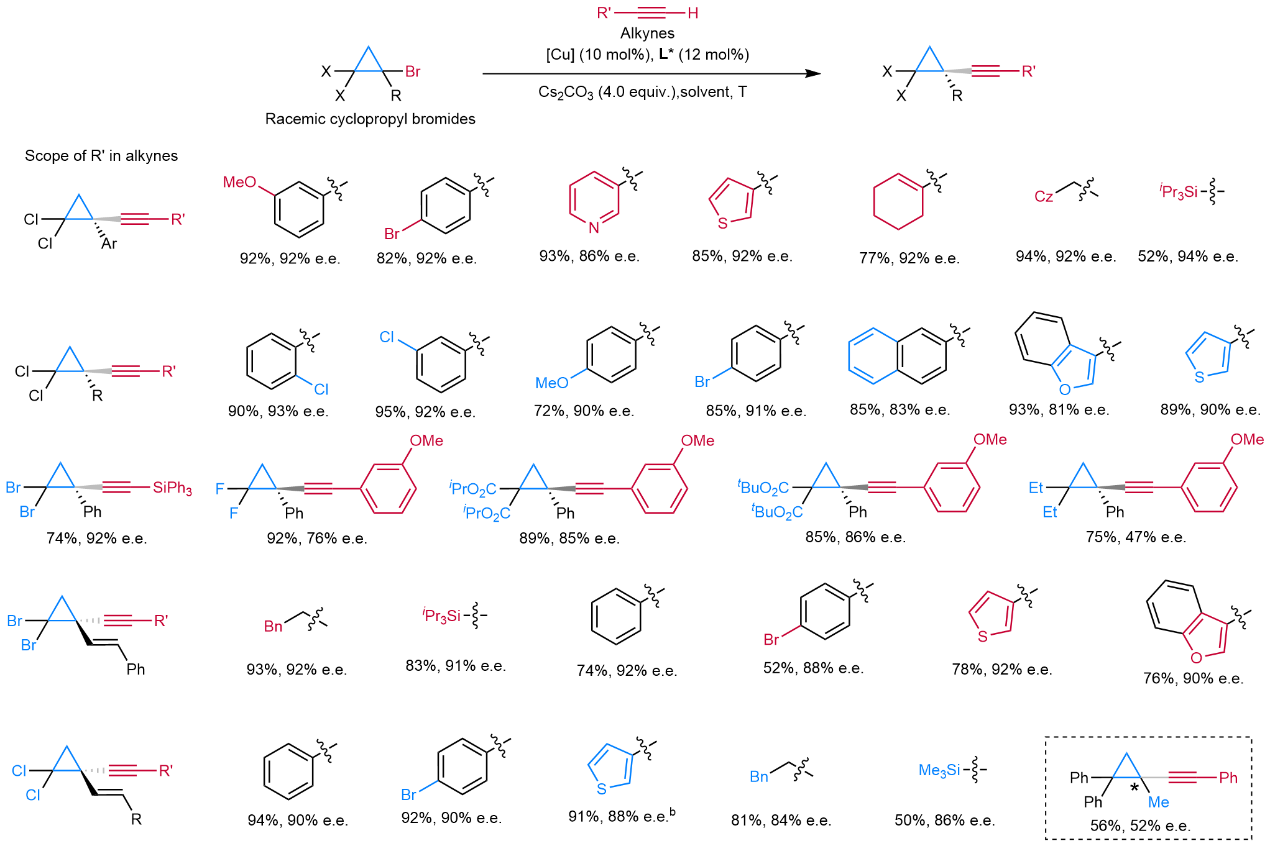
图2:底物范围(部分)。
该方法高对映选择性地实现了一系列手性炔基环丙烷分子的快速构建,底物适用范围广泛(>60个实例,图2)。在亲电试剂方面,各种外消旋1-(杂)芳基、1-烯基和1-烷基取代的环丙基卤代烃均能很好的兼容。在亲核试剂方面,各种官能化的芳基、杂芳基、烯基、烷基以及硅基等末端炔烃亦可顺利地进行。基于卤素和炔烃均能很好的转化,研究组快速构建了多种有价值的一至三个立体中心的手性环丙烷化合物,证实了该反应的实用性和应用价值(图3)。
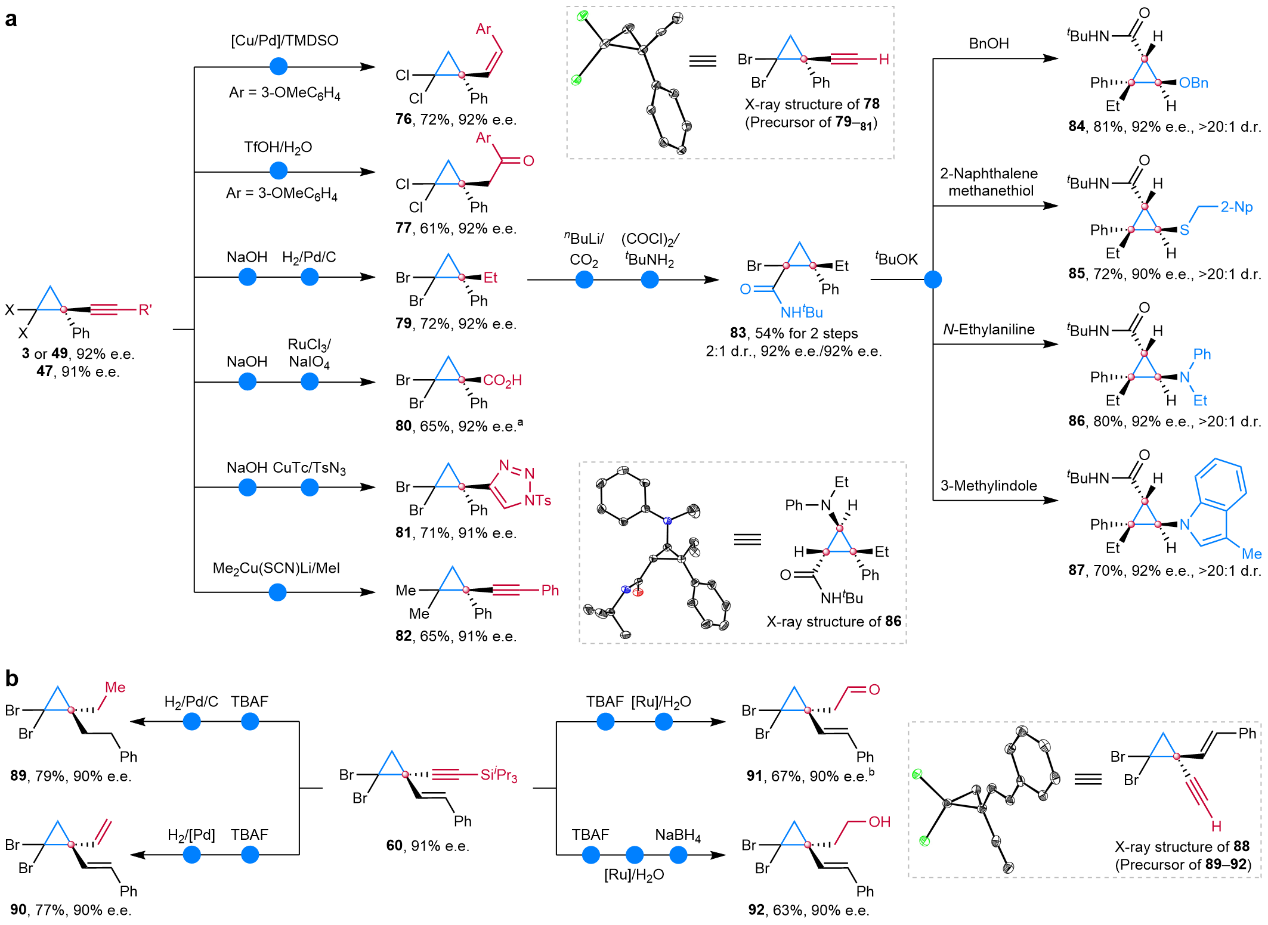
图3:手性炔基环丙烷化合物的转化应用研究。
为了揭示反应机理,作者进行了一系列的机理实验:首先手性铜炔物种可能是反应启动和产物生成的关键物种(图4a);其次无炔的控制实验证明炔烃参与了亲电试剂的还原(图4b);再者通过加入DMPO,证实了反应中形成了环丙烷自由基(图4c);使用消旋或手性的环丙烷卤代烃分别与末端炔烃反应,观察到环丙烷卤代烃的对映选择性(图4d),排除了反应经历动力学拆分过程的可能性。对于氧化还原态的调整,通过测试了加入一价或二价铜盐对反应主副产物的影响,表明该反应的化学选择性取决于Cu(II)物种的浓度(图4f)。基于以上的机理实验,作者提出了如下可能的反应机理(图4e)。
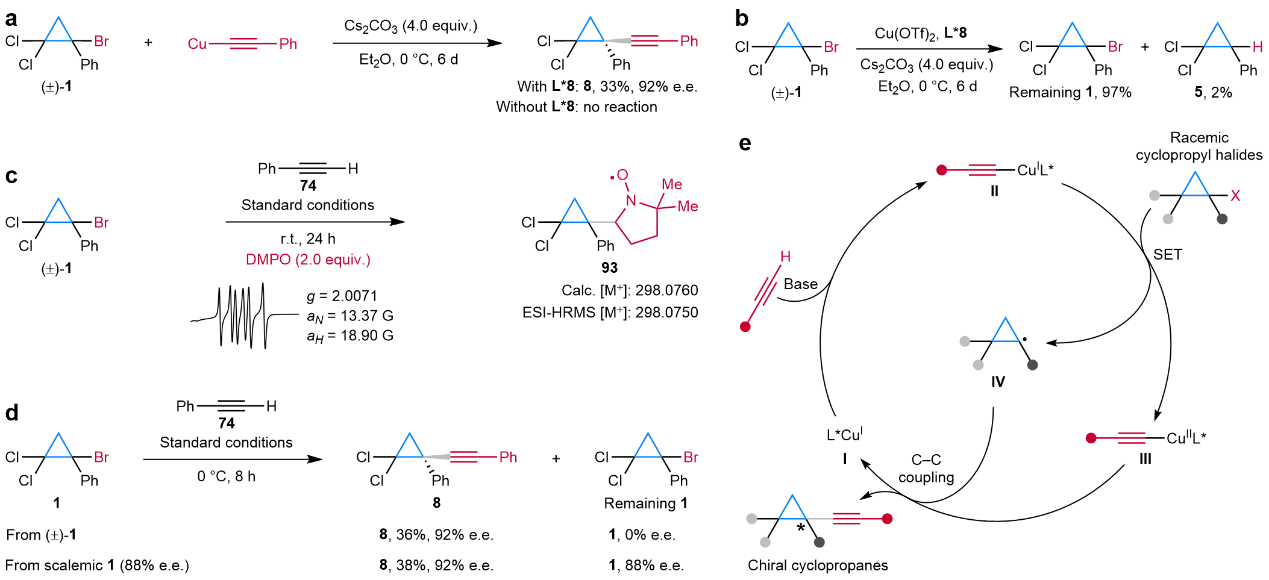
图4:机理研究。
刘心元团队发展了一个强大的催化体系,在温和的条件下,使用手性阴离子N,N,N-配体与Cu(II)盐的结合,从而提高Cu(II)物种的浓度,调整铜催化剂的氧化还原态,提高反应的化学选择性,实现了外消旋环丙烷卤化物与末端炔进行对映选择性自由基碳–碳交叉偶联反应。研究成果精准高效地构建了结构多样性的手性环丙烷分子砌块,为不对称自由基交叉偶联反应提供了可行策略和新思路。
该课题组所有研究项目得到了国家自然科学基金委员会、科技部、深圳市科创委、深圳市诺贝尔奖科学家实验室等项目的大力资助。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s44160-024-00654-x