大π共轭分子的高效C–H活化反应一直是一个在共轭材料合成领域具有挑战性的课题。最近,日本东京大学化学系的尚睿教授和中村荣一教授的团队成功开发了一种新的铁催化C-H氮杂环化反应的方法。这一新方法通过使用大体积的三齿膦配体,有效减少了铁-π相互作用的影响,从而显著提高了反应的选择性和效率,并成功合成了一系列潜在的有机光电材料。
相关研究成果发表在2024年7月9日的Nature Synthesis期刊上,论文题目为“Iron-catalysed C(sp2)–H activation for aza-annulation with alkynes on extended π-conjugated systems”。
论文通讯作者为尚睿教授和中村荣一教授,第一作者为博士生张岩。
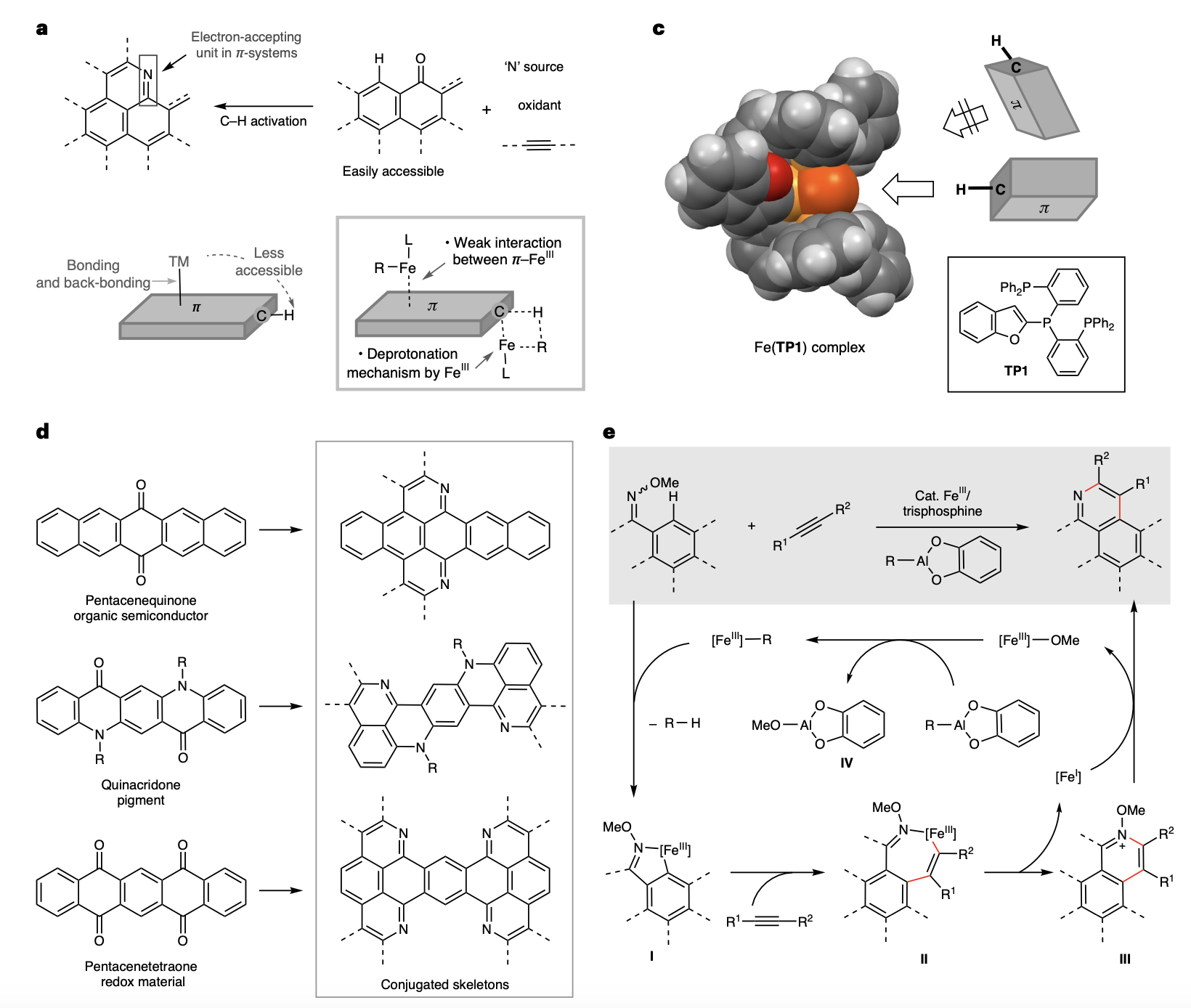
在有机化学和材料科学领域,开发高效且可持续的C–H活化方法对扩展π共轭系统至关重要。氮杂环化π扩展反应因其能够高效地在共轭分子上创建复杂的氮杂芳烃结构而备受关注。该反应将亚胺基团作为受体单元引入共轭系统,形成具有独特材料特性的供体-受体系统。该方法使用酮类化合物,在氮源和炔烃存在下直接通过C–H键活化进行反应。然而,过渡金属催化剂与大π系统之间的配位作用常常阻碍C–H活化反应的效率。
尚睿教授和中村荣一教授的团队开发了一种大体积三齿膦配体铁(III)催化剂,有效地解决了这一问题。该催化剂通过弱化金属与大π分子的相互作用,显著提升了催化效率和选择性。该体系使用廉价易得的异丁基铝(III)儿茶酚盐作为碱,通过炔烃与肟醚进行氮杂环化反应,成功实现了多种大π共轭分子的合成。该方法能够以五并苯醌、喹吖啶酮和并五苯四酮等经典有机半导体和染料前体为底物,经济高效地生产具有新型共轭骨架的分子以用于新型电子材料的开发。
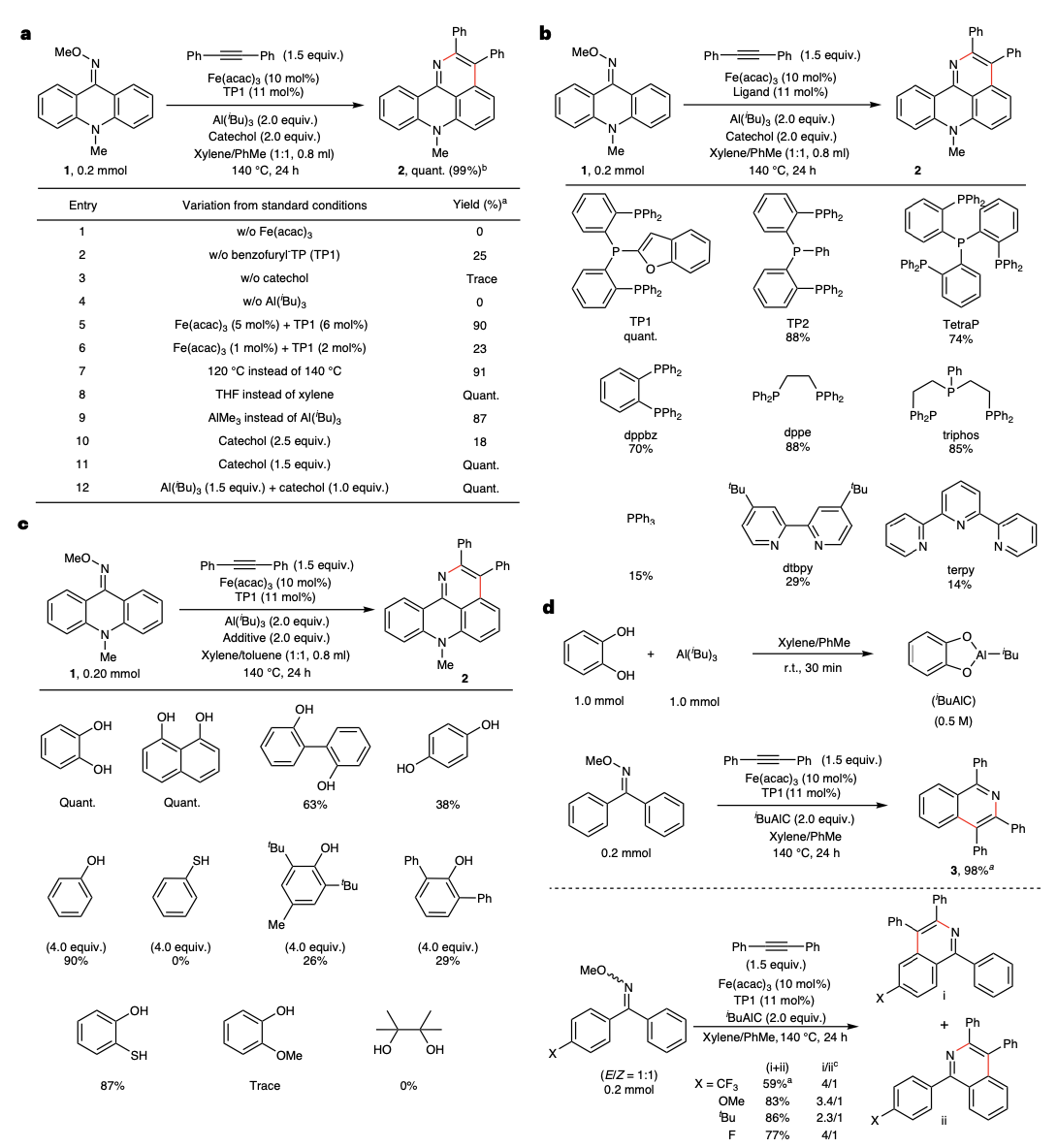
通过对不同条件的筛选,作者发现大体积的三齿膦配体(TP1)和儿茶酚的组合可以使肟醚原料当量转化为目标产物。值得注意的是,THF的使用可以被有效地避免,这对耐受低溶解性的大π分子的底物提供了帮助。初步的机理研究表明反应中原位生成的异丁基铝(III)儿茶酚盐是该体系的活性碱。
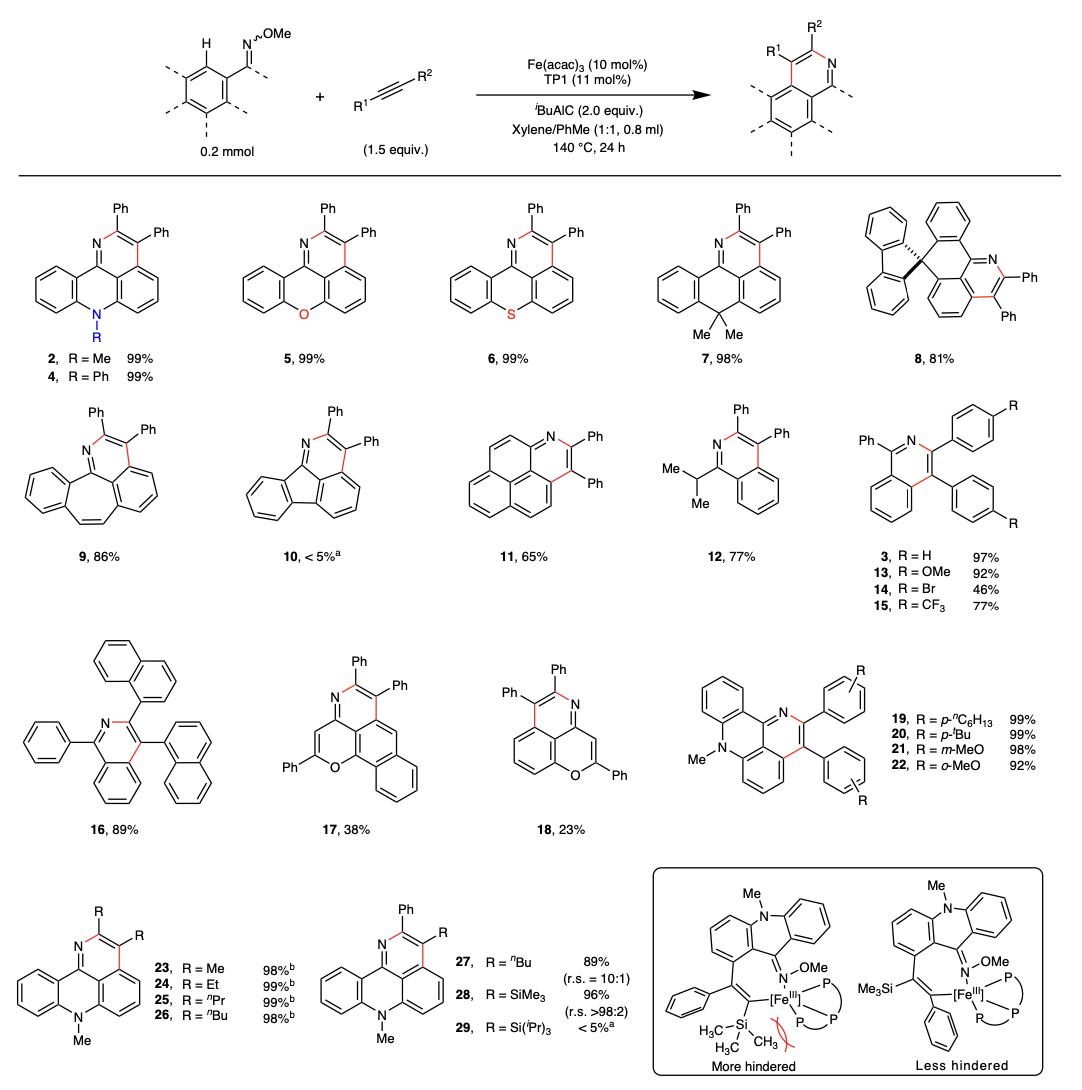
通过对不同肟醚底物的探究,该反应对于π共轭的肟醚表现出了极好的反应活性,大多数目标产物甚至能够以近乎当量的分离收率获得。对于炔烃底物,不仅是二芳基类的炔烃,二烷基取代的炔烃也表现出了优异的反应活性。值得注意的是,以2-丁炔作为底物,二甲基取代的氮杂芳烃(23)也可以98%的收率获得。该反应对于不对称的炔烃也表现出了良好的反应活性和选择性(27, 28)。该选择性被认为是由中间体的位阻效应决定的。
该反应体系还可用于二元环化,并以高区域选择性和较高收率得到了一系列新型双氮杂芳烃产物。
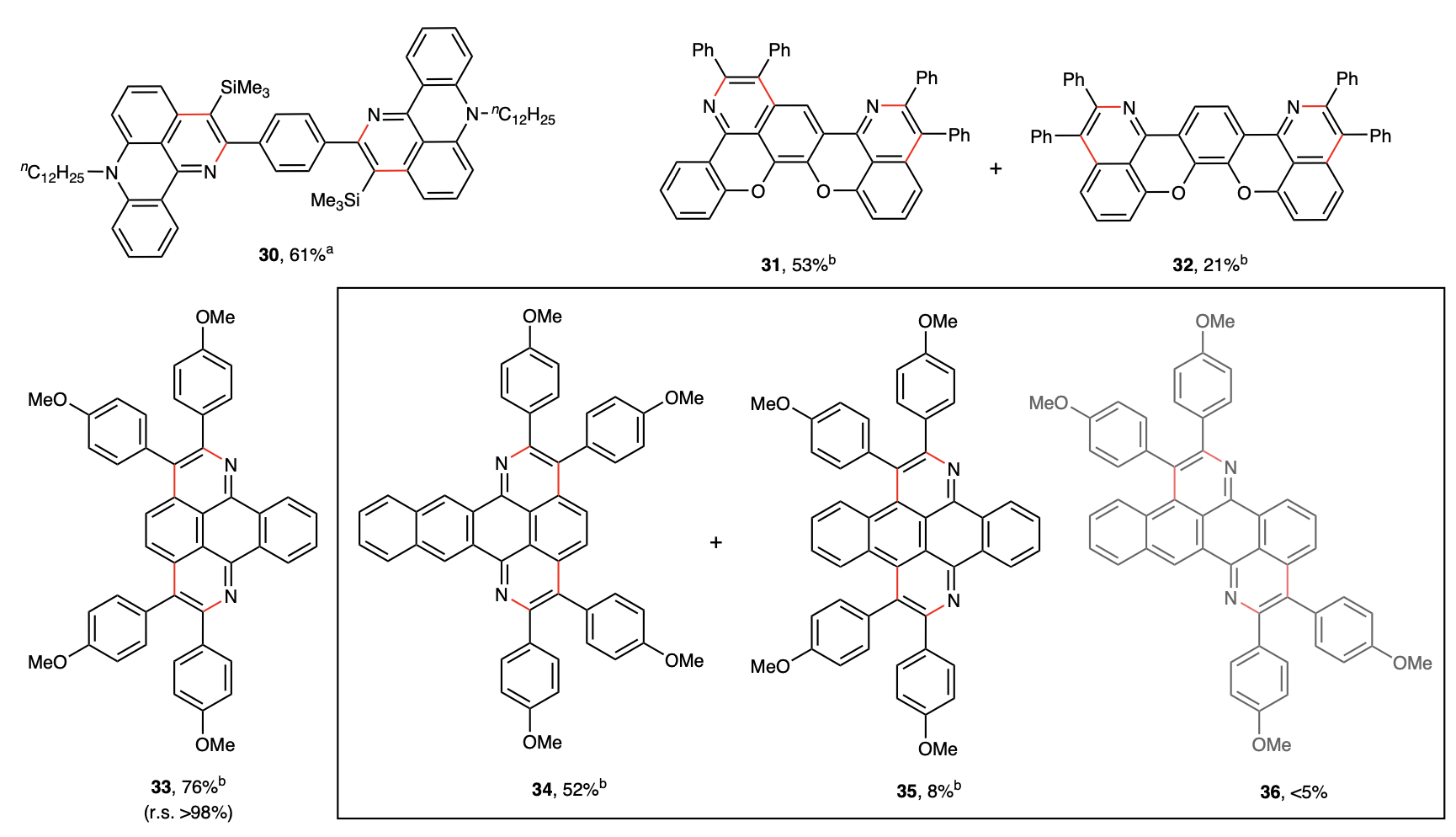
随后作者将此反应成功用于新型有机光电材料的开发,并成功合成了一类新的氮杂氧杂[5]螺烯分子。镜像的单晶结构证实了该骨架的两种螺手性。这为未来新型的偏振光分子的研究提供了更多的可能性。
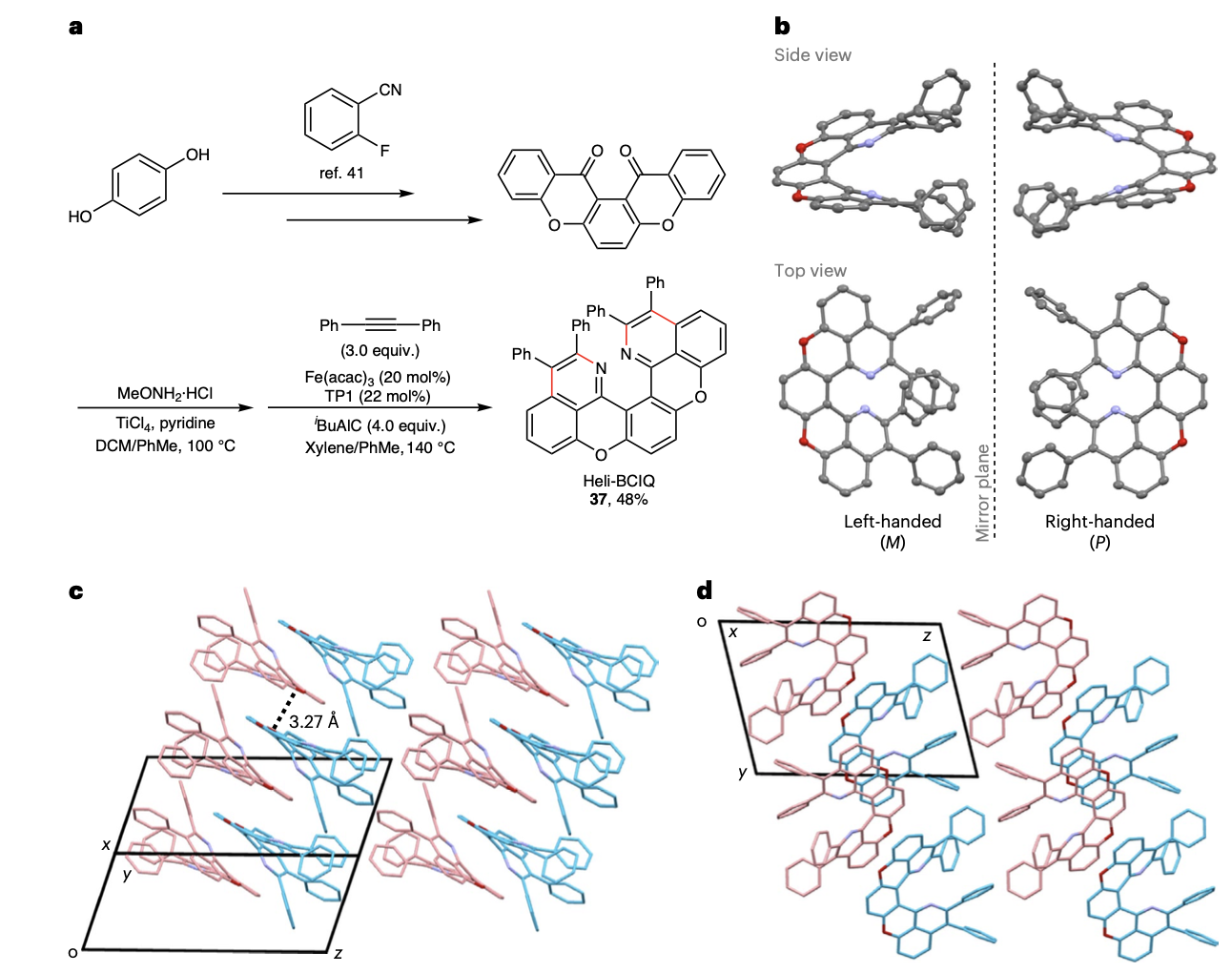
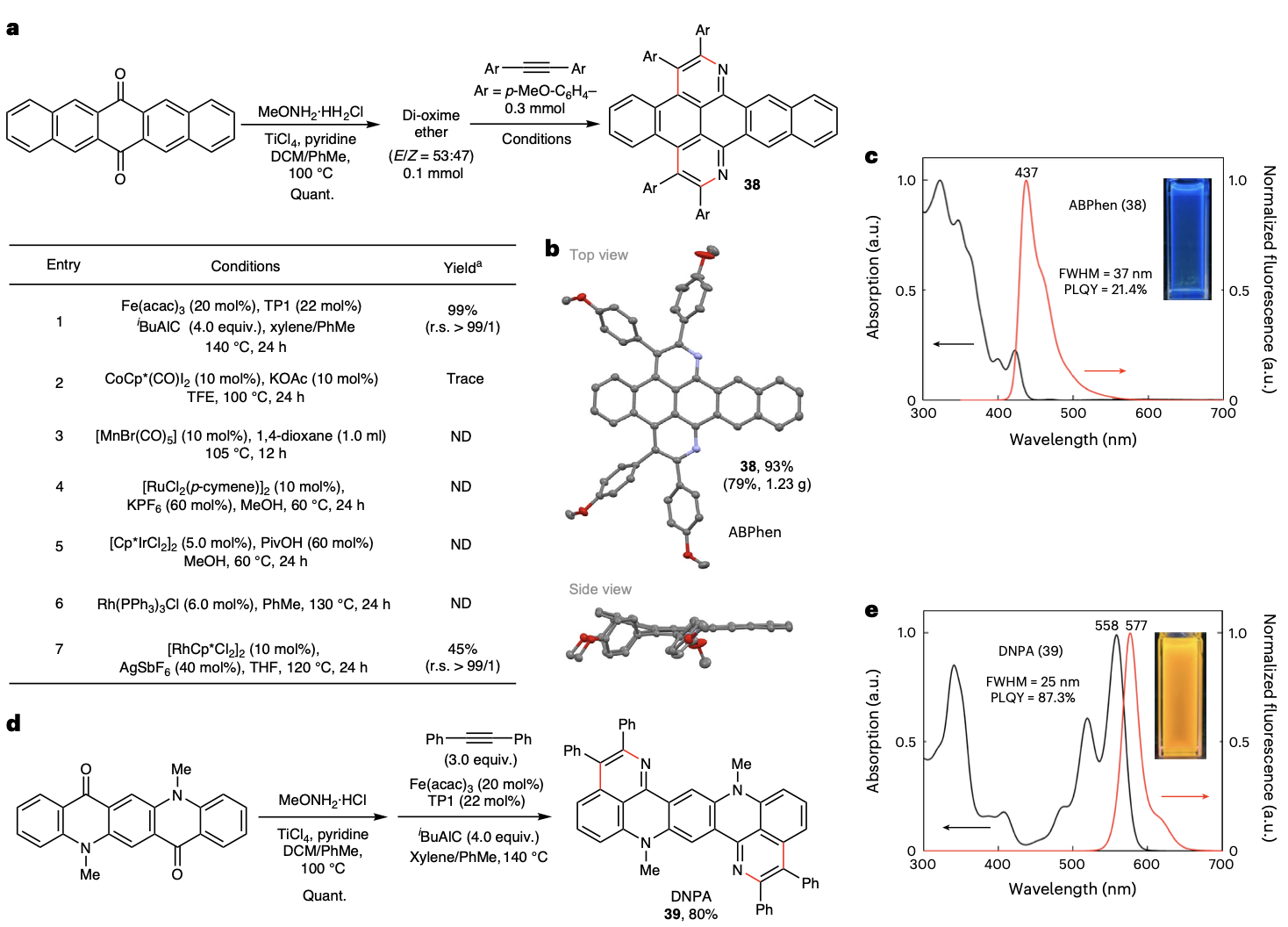
该方法还被成功用于有机半导体前体五并苯醌和染料喹吖啶酮的氮杂环化π扩展反应,并生成了两类新的窄带宽荧光分子。值得注意的是,作者以五并苯醌肟醚为底物对比了以往类似的不同金属催化的氮杂环化反应,发现只有该铁催化体系能够以高区域选择性和当量收率获得目标产物。
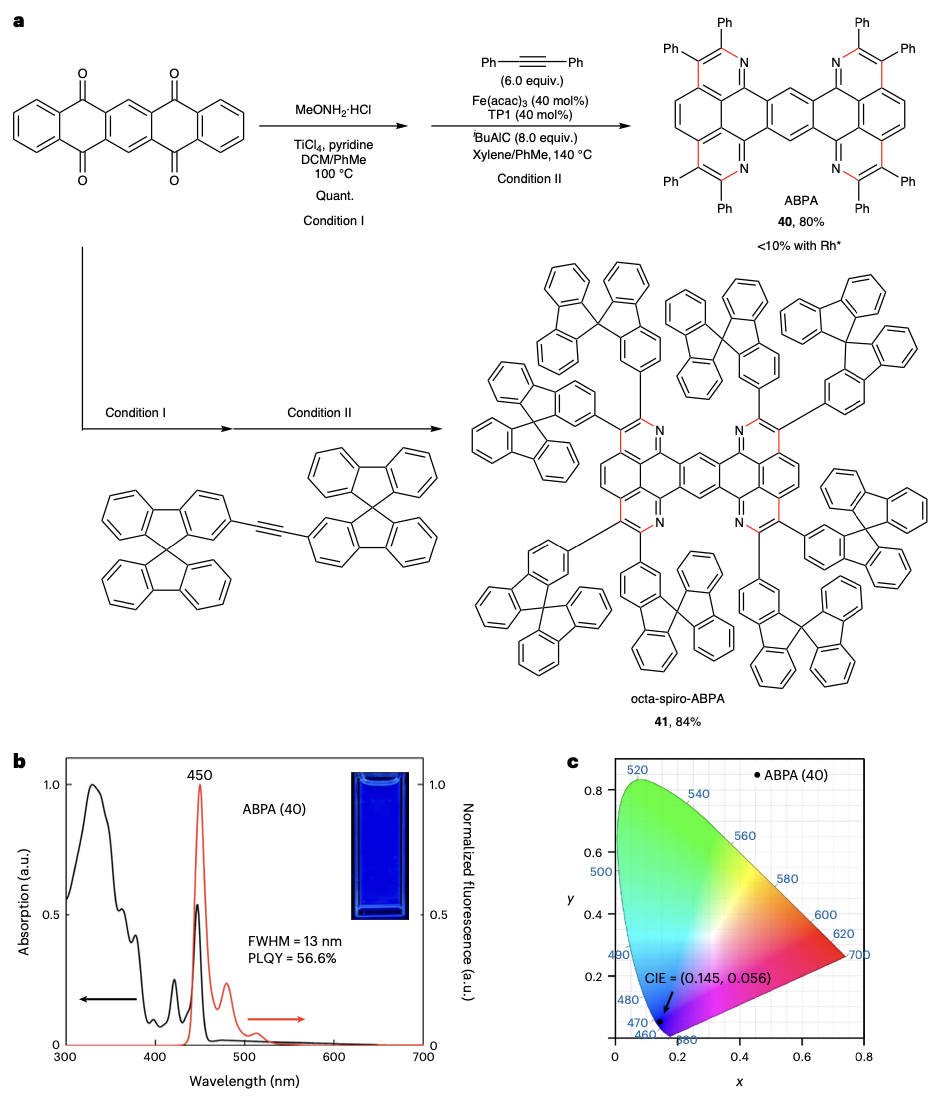
该反应体系还被拓展到四元环化。以并五苯四酮为底物,作者得到了一类新的深蓝光有机共轭骨架。化合物40在甲苯溶液中表现出了只有13纳米半峰宽的深蓝色发光(450纳米)。该骨架的成功发现为深蓝光有机发光二极管的研究提供了新的可能性。最后作者以螺二芴二炔为底物,通过四元环化以84%的分离收率得到了八螺二芴取代的共轭分子。
该研究利用氮杂环化π扩展反应通过高效的铁催化C–H活化策略成功开发了一系列共轭材料,不仅为高效有机金属催化提供了新的策略,还为有机光电材料的研究提供了更多可能。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s44160-024-00605-6