当植物受到病原体攻击时,植物会通过细胞内的NPR1 (NONEXPRESSOR OF PATHOGENESIS-RELATED GENES 1)蛋白质来激活体内的免疫反应,进而保护植物生长。
NPR1蛋白质是一个主要的植物免疫调节因子,调控2000多个与植物免疫有关的基因表达。虽然 NPR1 在植物防御中起到了非常重要的作用,但NPR1 的三维结构一直未知。尽管科学家们也一直在努力研究这种蛋白质是如何为植物提供保护,获取NPR1三维结构是深入理解NPR1蛋白质如何调节植物免疫力机制的关键。
2022年5月11日,Nature在线发表了美国杜克大学团队关于首个拟南芥(Arabidopsis thaliana) NPR1蛋白质和NPR1与转录因子TGA3的蛋白质复合物的三维空间结构,阐明了水杨酸诱导下NPR1对抗病原体基因的转录调控机理。
杜克大学医学院生物化学系周沛教授和生物系董欣年教授为该文共同通讯作者,研究助理Shivesh Kumar博士, Raul Zavaliev博士和吴清林博士为该文的共同第一作者。

文章标题截图
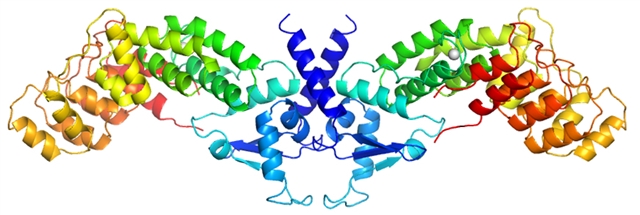
图1. 拟南芥NPR1冷冻电镜结构。
周教授和董教授的团队使用单颗粒冷冻电镜技术和X射线晶体学解析了拟南芥NPR1三维结构。NPR1是由BTB结构域,BHB结构域 (BTB and carboxyterminal Kelch helix bundle),4个ankyrin结构域和一个柔性的水杨酸结合结构域一起组成的飞鹰形的同源二聚体。NPR1的晶体结构还发现了其BTB结构域包含了一个独特的锌指结构,并且揭示了这个锌指结构在BTB结构域和ankyrin结构域的相互作用和NPR1多聚上发挥重要作用。

图2. NPR1-TGA3复合物冷冻电镜结构
该研究还报道了拟南芥NPR1和转录因子TGA3的复合物的冷冻电镜结构。这个复合物结构清晰地表明,二聚体NPR1通过桥接两个TGA3的二聚体组建一个转录增强子。另外,研究人员在TGA32-NPR12-TGA32以外还成功捕获了NPR12-TGA32复合物构象,并提出这种逐步组装过程可能反映了NPR1如何与同源或异源转录子结合来调控抵抗病原菌的基因转录的模型。他们通过使用电泳迁移分析法和遗传数据分析的方法验证了这个模型。
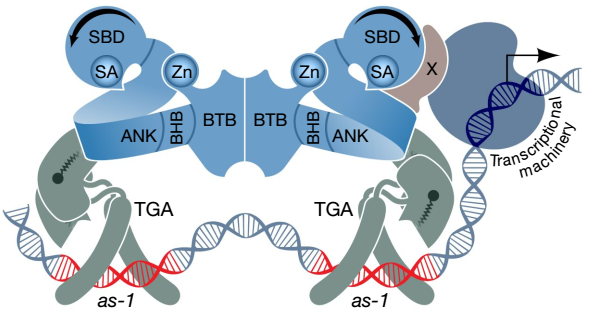
图3. 二聚体 NPR1 桥接两个二聚体 TGA 转录因子的增强体模型
自种植农作物以来,人类便开始与众多阻碍植物生长的害虫和病原体作斗争。比如,水霉菌马铃薯晚疫病菌(Phytophthora infestans)曾在18世纪的爱尔兰马铃薯饥荒中导致了100万人死亡和200万难民无家可归。NPR1基因从发现至今已有25年。此研究首次报道了NPR1的高分辨率的三维结构,并且从分子的水平上阐述了NPR1调控抗病原菌的基因转录机制。了解这种蛋白质如何发挥作用以及如何与其他分子协同互动,可以帮助研究人员设计出更优良的农作物, 对于极大增强植物的抗病性具有重要意义。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41586-022-04699-w