|
|
|
|
|
局部电渗疗法下的化疗药物搬运工——离子体 | MDPI Pharmaceutics |
|
|
论文标题:Iontosomes: Electroresponsive Liposomes for Topical Iontophoretic Delivery of Chemotherapeutics to the Buccal Mucosa
期刊:Pharmaceutics
作者:Kiran Sonaje et al.
发表时间:11 January 2021
DOI:10.3390/pharmaceutics13010088
微信链接:
https://mp.weixin.qq.com/s?__biz=MzI1MzEzNjgxMQ==&mid=2650000410&idx=3&sn=
77ab76f091dd9cd3f27c35d8b5242408&chksm=f1de76dec6a9ffc8c84be6eaa2166181031
f9377ea28e690cf6eb15418f3e055b3cb5a6cd0fd&token=1815605445&lang=zh_CN#rd
期刊链接:
https://www.mdpi.com/journal/pharmaceutics
对于不适合切除手术的口腔癌来说,抗癌治疗药剂的靶向局部递送为全身化疗提供了另一种选择。然而,上皮屏障功能对这种局部递送是一种阻碍。由此,克服颊黏膜这一屏障从而成功递送药物成为了治疗口腔癌过程中相当重要的一环。来自日内瓦大学的Yogeshvar Kalia教授及其团队在Pharmaceutics期刊上发表的文章中提出了用一种带电并且可以变形的脂质体——离子体将化疗药物递送至颊黏膜的方法以达到治疗口腔癌的目的。如图1所示,离子体在有效且可控的离子电渗疗法下,可以将化学治疗剂迅速递送至颊粘膜。

图1. 离子体的离子电渗粘膜递送的基本概念。
实验材料和方法
使用包含1,2-二油酰基-3-三甲基铵丙烷 (DOTAP) 和脂质类S75 (Lipoid-S75) 的阳离子脂质体可以实现顺铂 (CDDP) 和多西他赛 (DTX) 的共包封,通过传统脂质膜水合方法将含有DTX的脂质膜与含有CDDP的水溶液制备得到脂质体,不过此类脂质体中截留的水溶液体积较小,所以大量的CDDP实际并未进入脂质体,显然这种方法制备出来的阳离子脂质体对CDDP的包封率较低[1]。为了提高CDDP的包封率,作者使用1,2-二棕榈酰基-sn-甘油-3-磷酸-rac-甘油钠 (DPPG) 将CDDP配制成反胶束,反胶束和阳离子脂质膜的静电相互作用提高了CDDP的包封率。如图2所示,载有DTX的阳离子脂质膜与反胶束水合以后就是实验需要的离子体。作者发现,反胶束的体积越大,包封的CDDP含量也越高,不过相应的,DTX的含量会有降低。作者选择了对DTX和CDDP的包封率均相对较高的Lip-3离子体进行后续实验。通过低温TEM分析,所制备的离子体与常规的脂质体相比,其大小、形状、层状均一,并且可在电响应下发生形变。
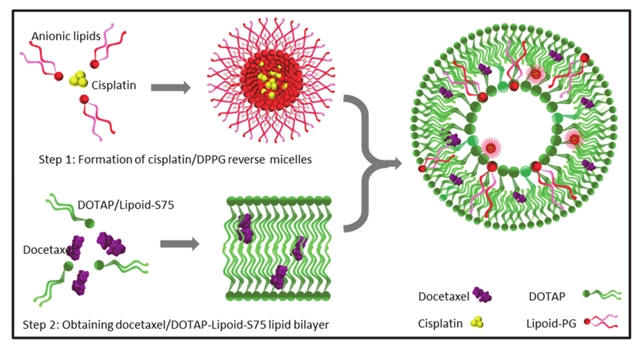
图2. 电响应离子体的配方。
作者研究了离子体在离子电渗疗法下的稳定性与体外药物释放。离子体在电渗疗法下由球形变得细长并且能够持续稳定地释放CDDP和DTX。随后,作者在体外评估离子体细胞毒性,通过对比空白无药物离子体、DTX溶液、CDDP溶液、DTX+CDDP混合溶液、以及含有CDDP+DTX的离子体这五组药物对细胞的毒性,实验发现,本次研究提出的含有CDDP以及DTX的离子体相比单种药物溶液或者混合药物溶液,表现出更大的细胞毒性。
猪颊黏膜是预测人口腔黏膜渗透的良好模型[2,3]。由于猪颊黏膜可用性有限,本文决定使用与颊组织有相似的结构和特性的猪食道黏膜进行实验[4]。使用猪食道黏膜进行的体外运输研究表明,如果没有外部驱动力,离子体就不会进入黏膜。完成离子体的黏膜递送实验后,作者发现包含药物的离子体在电渗疗法作用下保持得相对完整并且能够显著提高沉积在黏膜里的药物含量。
为了更好地了解整个转运过程,作者将其可视化。如图3所示,电渗疗法作用时间越久,越多的离子体粘附在黏膜表面,离子体的黏膜渗透性也明显提高。并且,离子体在黏膜中的穿透深度也可以通过改变电渗疗法的作用时间而改变。
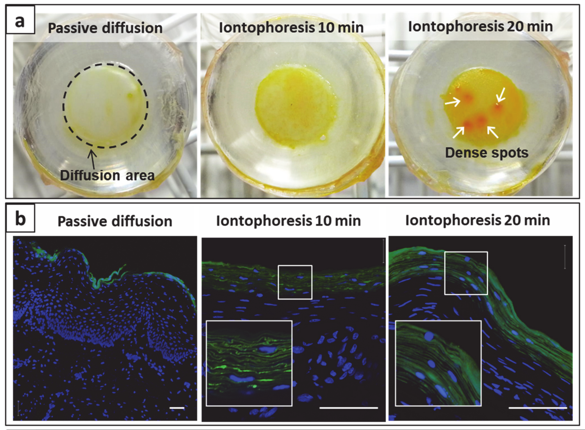
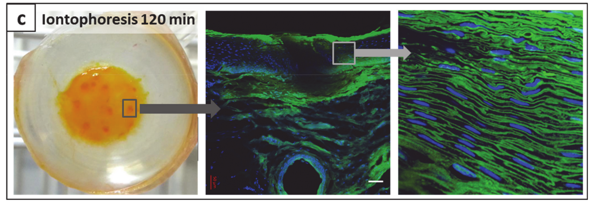
图3. 在不同持续时间的被动运输或者离子电渗疗后,通过黏膜组织沉淀和运输的离子体。
研究结论
通过这项工作,作者将两种物化性质不相容的化疗剂成功封装在可形变的离子体中,并且在电渗疗法的作用下,离子体发生形变从而渗透进黏膜中。离子体与电辅助递送相结合的方法为解决多种化疗药物选择性地递送至口腔黏膜这一问题提供了一种新思路。值得一提的是,这种方法也可以减少全身对化疗剂的吸收程度以及相关的副作用风险。
原文出自Pharmaceutics期刊
Sonaje, K.; Tyagi, V.; Chen, Y.; Kalia, Y.N. Iontosomes: Electroresponsive Liposomes for Topical Iontophoretic Delivery of Chemotherapeutics to the Buccal Mucosa. Pharmaceutics 2021, 13, 88.
参考文献:
1. Ça?da?, M.; Bucak, S.; Liposomes as potential drug carrier systems for drug delivery. In Application of Nanotechnolgy in Drug Delivery, Sezer, A.D., ed.; InTech: Rijeka, Croatia, 2014.
2. Gratieri, T.; Kalia, Y. Targeted local simultaneous iontophoresis of chemotherapeutics for topical therapy of head and neck cancers. Int. J. Pharm. 2014, 460, 24–27.
3. Diaz-Del Consuelo, I.; Pizzolato, G.P.; Falson, F.; Guy, R.H.; Jacques, Y. Evaluation of pig esophageal mucosa as a permea-bility barrier model for buccal tissue. J. Pharm. Sci. 2005, 94, 2777–2788.
4. Consuelo, I.D.-D.; Jacques, Y.; Pizzolato, G.-P.; Guy, R.H.; Falson, F. Comparison of the lipid composition of porcine buccal and esophageal permeability barriers. Arch. Oral Biol. 2005, 50, 981–987.


特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。