|
|
|
|
|
QB | 前沿研究:三重矩阵分解对药物细胞系反应的可解释性预测 |
|
|
论文标题:Interpretable prediction of drug-cell line response by triple matrix factorization (三重矩阵分解对药物细胞系反应的可解释性预测)
期刊:Quantitative Biology
作者:Xiao-Ying Yan, Shao-Wu Zhang, Siu-Ming Yiu, Jian-Yu Shi
发表时间:15 Jul 2021
DOI:10.15302/J-QB-021-0259
微信链接:点击此处阅读微信文章

个性化医疗的挑战之一是为常见疾病患者确定特定的药物及其剂量。细胞系技术提供了一种安全的方法来预测患者对不同剂量药物的反应。一般而言,通过生物实验来测定确定细胞中的药物反应花费昂贵。计算方法能够在患者个体细胞层面上实施大规模、快速且低成本的药物反应筛选,可以为生物实验缩小搜索范围。然而,现有的计算方法极少能解释药物反应的潜在原因。
西北工业大学张绍武教授团队和施建宇教授团队最新提出了三重矩阵分解(TMF)模型用于分析和预测跨细胞系的药物反应,相关研究“Interpretable prediction of drug-cell line response by triple matrix factorization”发表于Quantitative Biology期刊(点击文末“阅读原文”下载PDF全文)。该模型可将药物特征(例如,化学结构指纹)、细胞特征(例如,基因表达谱)和跨细胞的药物反应(通过 IC50 测量)连接起来,使得药物在特定细胞中的反应在特征层面上具备解释性。通过肺癌相关细胞系的药物反应实例,TMF在三个方面展示了其可解释的能力,包括频繁出现的药物子结构,关键的突变基因,以及对于区分敏感性和耐药性起到重要贡献的“药物子结构-突变基因”配对。该模型与最先进的算法相比,具有明显的优越性。

全文概要
作者首先从GDSC(Genomics of Drug Sensitivity in Cancer project)中搜集所需要的数据集,包括183种药物、962个细胞系以及它们之间142,451条响应条目,构建了相应的响应矩阵Y,药物特征矩阵Fd和细胞系特征矩阵Fc(图1),研究了不同归一化策略及参数对预测结果的影响。同时还研究了TMF模型对噪声数据和不完整数据的鲁棒性。

图1. TMF模型示意图
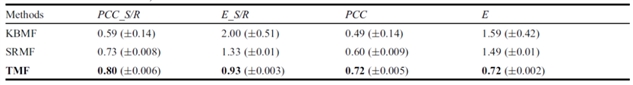
通过与两种最先进的基于矩阵分解算法KBMF和SRMF相比,TMF都表现出明显的优势(表1)。此外,作者还将TMF与MVLR, HNMDRP和NRL2DRP这三种算法进行了比较,MVLR是基于回归的方法,HNMDRP和NRL2DRP则是基于网络推断的方法,同样也发现TMF算法优于这三种方法。衡量指标为:相关系数PCC和均方误差E,前者越大越好,后者越小越好。
表1. Results of KBMF, SRMF and TMF on GDSC dataset with 10-CV test
更重要的是,作者挑选了数据集中最常见的肺癌细胞系及相应的药物进行了案例研究,并尝试回答了三个问题:
(1)为什么细胞系对药物表现出显著反应?
(2)所有药物中频繁出现的子结构是什么,为什么一组药物会触发特定细胞系在药物特征(子结构)方面的反应?
(3)所有细胞系中重要的突变基因是什么以及为什么一组细胞系对特定药物表现出显著反应?
最后,作者认为如果将TMF扩展到整合药物和细胞系的更多异质特征后将会更好的改善预测,并更有利于理解细胞系对药物敏感或耐药的原因。
摘要
Background: One of the challenges in personalized medicine is to determine specific drugs and their dosages for patient individuals who are undergoing a common disease. The technique of cell lines provides a safe approach to capture the drug responses of patient individuals when given specific drugs with varied dosages. However, it is still costly to determine drug responses in cells w.r.t dosages by biological assays. Computational methods provide a promising screening to infer possible drug responses in the cells of patient individuals on a large scale. Nevertheless, existing computational approaches are insufficient to interpret the underlying reason for drug responses.
Methods: In this work, we propose an interpretable model for analyzing and predicting drug responses across cell lines. The proposed model bridges drug features (e.g., chemical structure fingerprints), cell features (e.g., gene expression profiles), and drug responses across cells (measured by IC50) by a triple matrix factorization (TMF), such that the underlying reason for drug responses in specific cells is possibly interpreted.
Results: The comparison with state-of-the-art computational approaches demonstrates the superiority of our TMF. More importantly, a case study of drug responses in lung-related cell lines shows its interpretable ability to find out highly occurring drug substructures, crucial mutated genes, as well as significant pairs between substructures and mutated genes in terms of drug sensitivity and resistance.
Conclusion: TMF is an effective and interpretable approach for predicting cell lines responses to drugs, and can dig out crucial pairs of chemical substructures and genes, which uncovers the underlying reason for drug responses in specific cells.
QB期刊介绍
Quantitative Biology (QB)期刊是由清华大学、北京大学、高教出版社联合创办的全英文学术期刊。QB主要刊登生物信息学、计算生物学、系统生物学、理论生物学和合成生物学的最新研究成果和前沿进展,并为生命科学与计算机、数学、物理等交叉研究领域打造一个学术水平高、可读性强、具有全球影响力的交叉学科期刊品牌。
QB期刊目前已被ESCI, Scopus, CSCD等国内外重要数据库收录。
《前沿》系列英文学术期刊
由教育部主管、高等教育出版社主办的《前沿》(Frontiers)系列英文学术期刊,于2006年正式创刊,以网络版和印刷版向全球发行。系列期刊包括基础科学、生命科学、工程技术和人文社会科学四个主题,是我国覆盖学科最广泛的英文学术期刊群,其中13种被SCI收录,其他也被A&HCI、Ei、MEDLINE或相应学科国际权威检索系统收录,具有一定的国际学术影响力。系列期刊采用在线优先出版方式,保证文章以最快速度发表。
中国学术前沿期刊网
http://journal.hep.com.cn

特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。