近日,中国科学院上海有机化学研究所何智涛课题组报道了铜催化的不对称炔烯丙基取代反应,并对反应机理进行了初步探索。相关科研成果以“Copper-catalysed convergent regio- and enantioselective alkynylallylic substitution”为题于2022年10月24日在Nature Synthesis期刊上发表。
林国强院士和何智涛研究员为论文共同通讯作者,上海有机所研究生马江山和上海科技大学研究生陆汉瑀为文章共同第一作者。
烯丙基取代和炔丙基取代反应是有机化学中的一类重要反应,不对称的烯丙基和炔丙基取代反应在实现分子手性中心的构筑方面均具有广泛的应用。在该类型的反应中,过渡金属与底物反应所形成的 3-π金属络合物被认为是反应的活性中间体。中国科学院上海有机所何智涛团队一直致力于基于过渡金属的
3-π金属络合物被认为是反应的活性中间体。中国科学院上海有机所何智涛团队一直致力于基于过渡金属的 3-π络合物的新型合成方法学的开发(J. Am. Chem. Soc. 2021, 143, 7285–7291;Nat. Commun. 2021, 12, 5626),最近,该课题组在Nature Synthesis上发表了新的突破,即利用铜催化实现了不对称的炔烯丙基取代反应,反应的收率,区域选择性和立体选择性均十分优异。手性1,4-烯炔产物同时含有两种不饱和键片段,通过定向转化烯键和炔键,能够获得更大的转化修饰空间(图1a)。同时,这也代表了一种新颖的不对称远程炔丙基取代的策略,通过在炔键和离去基之间增加一个烯键来促进电子的转移传递,从而推动γ位离去基的脱除(图1b, 1c)。
3-π络合物的新型合成方法学的开发(J. Am. Chem. Soc. 2021, 143, 7285–7291;Nat. Commun. 2021, 12, 5626),最近,该课题组在Nature Synthesis上发表了新的突破,即利用铜催化实现了不对称的炔烯丙基取代反应,反应的收率,区域选择性和立体选择性均十分优异。手性1,4-烯炔产物同时含有两种不饱和键片段,通过定向转化烯键和炔键,能够获得更大的转化修饰空间(图1a)。同时,这也代表了一种新颖的不对称远程炔丙基取代的策略,通过在炔键和离去基之间增加一个烯键来促进电子的转移传递,从而推动γ位离去基的脱除(图1b, 1c)。
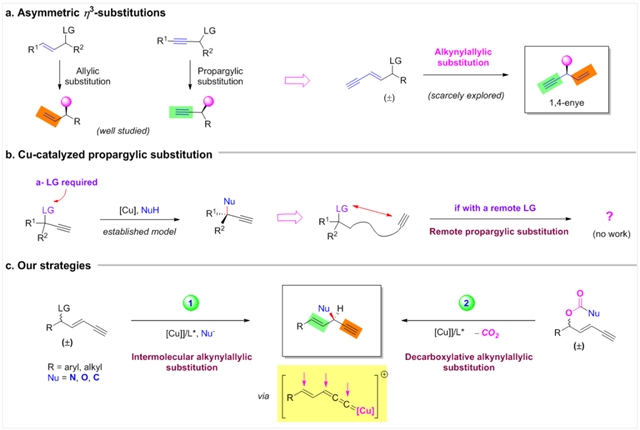
图1:不对称炔烯丙基取代反应设计
经过一系列反应条件的考察,该团队确定了反应的最优条件。一价铜,二价铜以及含水二价铜三种体系均可以实现该反应(图2a)。在该反应体系下,分子间取代和脱羧分子内取代两种转化过程均能顺利发生,并对一系列官能团均具有非常好的兼容性。药物分子和生物活性分子衍生物也能以优异的产率和选择性参与反应。该反应可兼容水和空气,并能进行克级规模的制备(图2b)。手性1,4-烯炔产物的炔键和烯键可以分别进行click反应、Sonogashira偶联、Larock吲哚环化以及RCM关环等不同类型的转化(图2c)。值得一提的是,该团队可以实现“炔丙基取代+脱羧炔丙基取代+炔烯丙基取代+脱羧炔烯丙基取代”的归一化转化,从八种原料的混合物出发得到了单一的手性产物(图2d)。
该团队进一步发展了Cu/Lewis酸协同催化的策略,实现了不对称炔烯丙基醚化和烷基化反应,将亲核试剂的范围由氮进一步扩大至碳和氧亲核试剂,极大地拓展了该领域的应用范围(图3)。


图2:反应的条件和转化
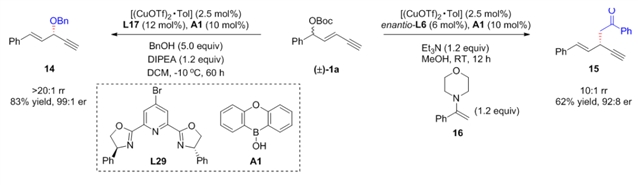
图3:碳亲核试剂和氧亲核试剂参与的取代反应
作者开展了一系列机理实验来揭示该反应的机制。动力学实验表明该反应对一价铜是二级反应,对底物和亲核试剂是零级反应;对一价铜、二价铜以及含水二价铜催化反应的非线性效应研究均表明多个配体参与了对映选择性决定步骤(图4a);通过Cu(I)和Cu(II)的络合物单晶结构,作者发现二者采用了不同的配位模式,即一价铜为双核双配体,而二价铜为单核双配体(图4b)。这突破了以往会认为二者具有类似的催化和配位模式的观点。

图4:反应机理研究
基于上述反应机制的研究,作者提出了如下的手性诱导模型和可能机理(图5)。铜在碱存在下攫取底物1a端炔的氢形成炔基铜物种Int-1。随后离去基的脱除,形成共振平衡的关键中间体炔基铜和联烯基铜卡宾物种Int-2-4,这也是反应的决速步骤。该中间体随后被亲核试剂2a所捕获,形成中间体Int-5,再经历质子转移生成产物3a,释放催化剂完成催化循环。
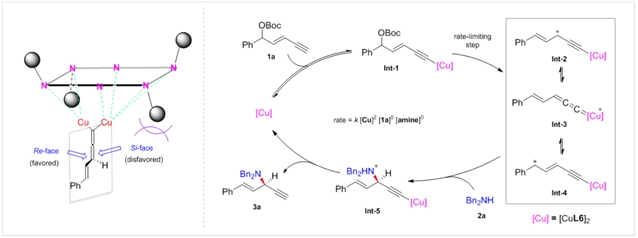
图5:手性诱导模式和可能机理
该研究得到了林国强课题组的大力支持。感谢国家自然科学基金委、上海市科委、中科院、上海有机所以及天然产物有机合成化学重点实验室的资助。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s44160-022-00176-4