日前,新加坡国立大学卢一新教授研究团队在新型轴手性化合物的设计与合成研究中取得了突破性研究进展,郑州大学特聘教授梅光建为该文第一作者。该研究首次实现了非碳单键N–N轴手性化合物的不对称构建。研究成果以“Rational design and atroposelective synthesis of N–N axially chiral compounds”为题,于2021年8月18日发表在Chem上。
手性是自然界的本征特性之一。不同手性的对映异构体会在生物活性以及功能上表现出差异。因此,新型手性化合物的开发以及它们的不对称合成是当前有机合成的最前沿领域。
与常见的中心手性化合物不同,轴手性化合物源于单键的旋转受阻。近年来,轴手性化合物在天然产物合成、有机小分子催化剂以及手性配体的合成中有着广泛的应用。轴手性化合物的催化不对称构建备受关注。
然而现有的研究体系都是基于旋转受阻的含碳单键C–X(X = C, N, O, B)。非碳单键轴手性化合物的不对称构建仍属未知领域。
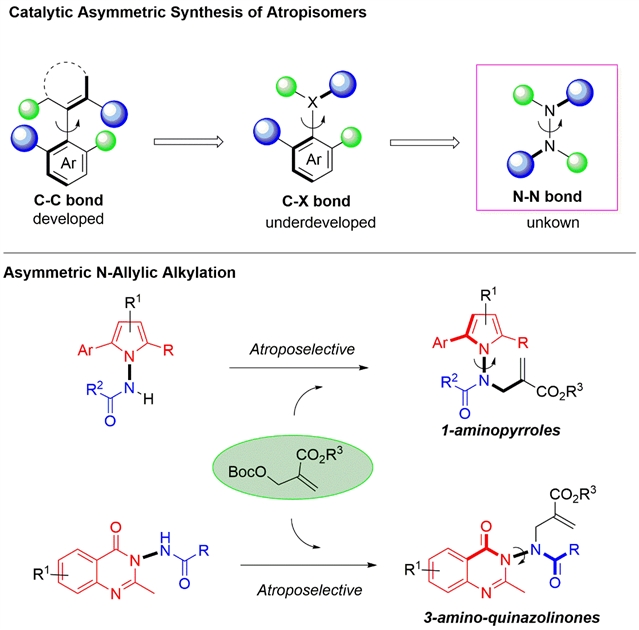
图1:N–N轴手性化合物的设计与合成
该论文的第一作者为郑州大学化学学院学科骨干特聘教授,梅光建博士,他告诉《中国科学报》,非碳单键轴手性化合物的不对称构建是一项极具挑战的课题:非碳单键具有较低的键能,会增加分子的不稳定性;非碳单键两端平面是不规整、不正交的。这使得非碳单键的旋转相对能垒较低,轴手性难以稳定存在。
在该文的研究中,作者巧妙地设计了两类非碳单键N–N轴手性化合物,并首次实现了它们的不对称合成。“N–N键具有较短的键长,会使得两端的取代基团更容易靠近,从而增加旋转位阻;同时,N–N键两端的氮原子各有一对孤对电子,它们在单键的旋转过程中会产生电子排斥作用,这些因素为N–N轴手性的形成以及不对称构建提供可能。”梅光建博士介绍道。
具体而言,研究人员设计了两类非碳单键N–N轴手性化合物,分别是1-氨基吡咯体系和3-氨基喹啉酮体系。并利用不对称烯丙基化反应,过对N–N键进行修饰,从而实现了非碳单键N–N轴手性化合物的首次催化不对合成。通过研究发现,该反应具有反应条件温和、底物适用广泛等特点。此外,作者在1-氨基吡咯体系的研究中发现了较为有趣的远程手性控制现象,并通过与Houk计算化学团队合作研究,证实该现象是由手性催化剂和底物之间的氢键作用导致产生的。
最后,研究人员认为,该工作提出的非碳单键N–N轴手性化合物不仅为手性化合物的研究提供了开创性的研究思路,同时也将会在手性催化剂/配体构建以及生物医药的合成等方面有重要的应用前景。(来源:科学网)
相关论文信息:https://doi.org/10.1016/j.chempr.2021.07.013