骨骼肌遭受严重损伤后,尤其是在大体积肌肉损伤情况下,促进组织再生的同时,如何提供安全、有效且可持续的干预,一直是组织修复领域的重要挑战。
中国科学院过程工程研究所研究员白硕带领团队构建了一种“完全可降解、自供电”的肌肉修复电刺激系统(MD-ES),将可降解材料体系与原位电刺激干预集成为一体化的植入方案。这一系统推动了全降解自供电、植入式电刺激治疗设备在肌肉损伤修复中的应用。相关成果于1月17日发表在Cell Biomaterials上。
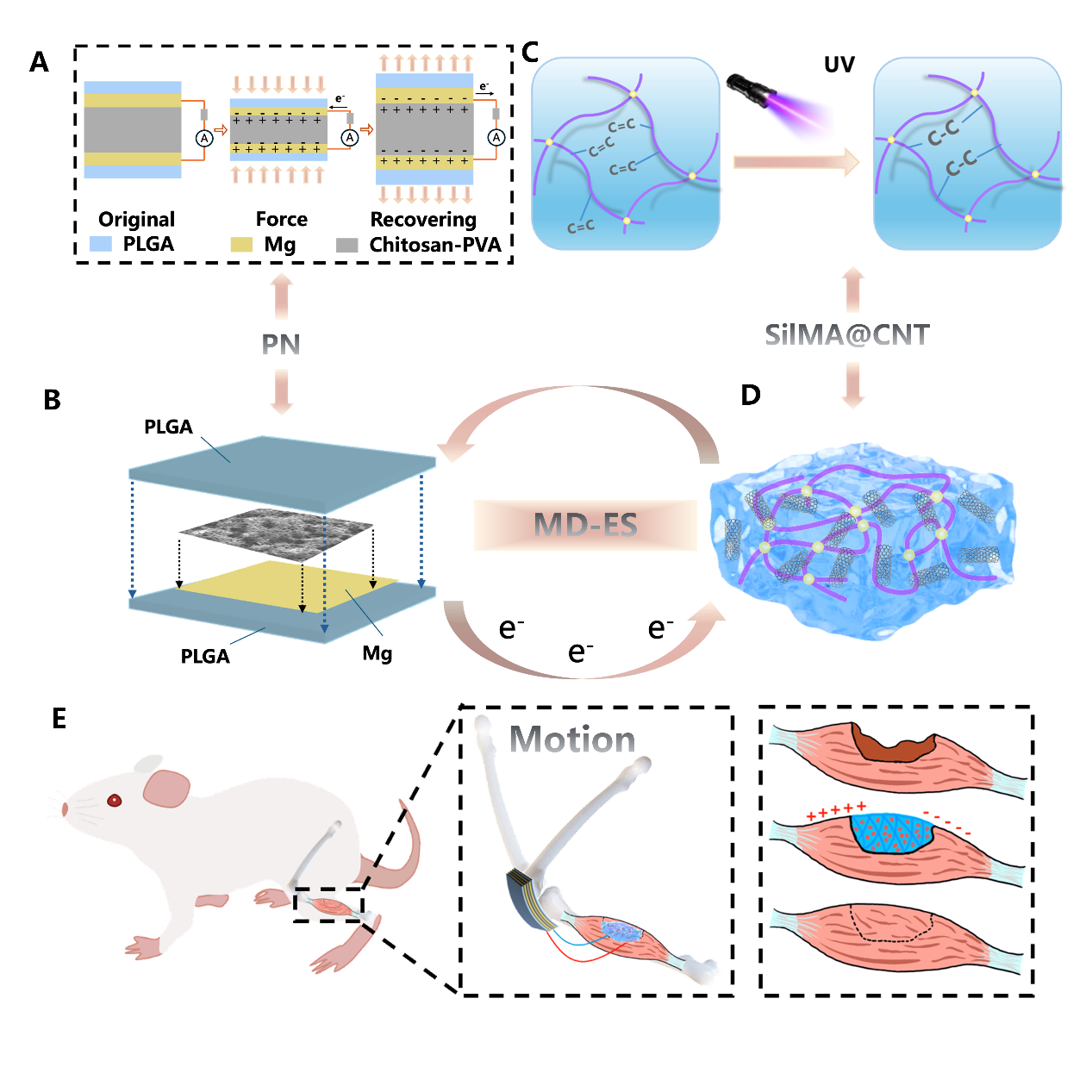 MD-ES自供电系统的结构设计及骨骼肌修复应用示意图。研究团队供图
MD-ES自供电系统的结构设计及骨骼肌修复应用示意图。研究团队供图
骨骼肌约占人体体重的40%~50%,是维持日常活动与运动功能的重要组织。但当发生严重缺损,特别是大体积肌肉缺损时,靠机体自身修复往往难以实现有效再生,进而导致肌力下降、活动受限,乃至长期功能障碍。目前,临床常用的自体肌肉移植与康复训练等策略面临着供体不足、匹配困难与恢复周期长等局限。
电刺激疗法因可模拟生物电并促进修复而受到关注。然而,传统电刺激方式往往依赖体外供能,植入电极操作不便、舒适性不足,且植入式电刺激器件体积庞大,限制了其长期、稳定应用,同时也增加了患者负担。
针对上述问题,研究团队提出并构建了一种新型肌肉缺损电刺激自供电系统(MD-ES)。该系统由两部分核心组件组成,包括基于壳聚糖-聚乙烯醇(CS-PVA)复合生物膜压电单元(PN),以及以丝素蛋白为基体的水凝胶支架作为电刺激接收端与组织工程支架。
实验结果显示,该压电膜在5000次连续压力循环下能够稳定地产生约500 mV的电压而无明显衰减,这是已报道的壳聚糖作为核心压电材料的最高性能之一。该系统的PN单元可植入关节皮下,利用关节运动产生电信号,并传递至肌肉损伤部位的导电水凝胶支架,从而实现对肌肉损伤部位的原位实时电刺激。
科研人员介绍,该电刺激与组织工程支架的微环境相结合,增强成肌细胞增殖和分化来促进肌肉修复。通过材料结构调控,器件在柔韧性与电流输出稳定性上得到提升,其可降解封装设计则确保了在体内可被完全吸收。在大鼠骨骼肌损伤模型中,该系统展示了肌肉在两周内完全恢复的潜力,并且刺激器在大约四周后完全降解。
这项研究为肌肉损伤治疗提供了一种新型的植入式全降解器件化的思路。
相关论文信息:https://doi.org/10.1016/j.celbio.2025.100314
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。