据最新一期《科学》杂志报道,西班牙巴塞罗那基因组调控中心和英国威康桑格研究所的研究人员发现,蛋白质的核心区域比此前认为的更稳定、更具容错性,颠覆了蛋白质如多米诺骨牌一般,具有“牵一发而动全身”的脆弱结构的认知。该成果有望显著提升蛋白质设计效率,加速新药、新酶等生物产品的开发进程。
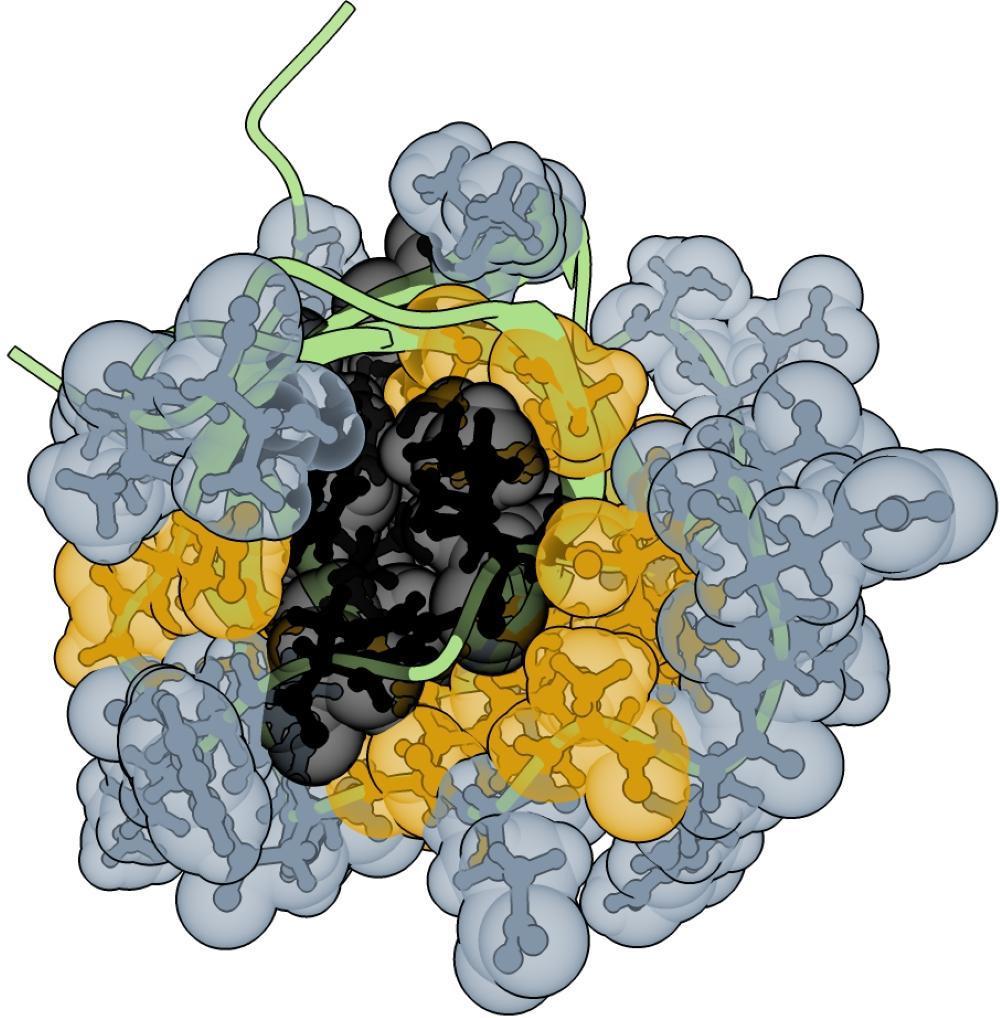
被随机化处理的蛋白质核心区域(图中为金色和黑色)和表面区域(银色)残基。图片来源:西班牙巴塞罗那基因组调控中心
蛋白质由20种氨基酸组成,其可能组合数量极其庞大。即便一个仅含60个氨基酸的小蛋白,其排列组合方式也高达10的78次方,几乎与宇宙中原子数量相当。面对如此复杂的组合可能性,科学界长期不解,为何进化能从中筛选出少数结构稳定、功能可靠的组合?
过去主流观点认为,蛋白质核心区域的氨基酸堆叠紧密,任意改动都可能导致整体结构失稳。但最新研究显示,这一传统观念并不准确。
研究人员选择了一种叫SH3的小型蛋白结构作为研究对象,它广泛存在于各种生物体内。接着,他们制造了数十万个略有不同的SH3版本,并测试它们是否还能正常折叠和发挥功能。结果显示,绝大多数变体均能维持稳定结构。真正不可改动的“关键氨基酸”仅占少数。这意味着,蛋白质的折叠规则比过去认为的要“宽容”得多。
研究人员还基于实验数据建立了机器学习模型,用于预测蛋白质序列的稳定性。该模型在对比超过5万个来自细菌、植物、昆虫和人类的自然SH3序列时,准确率极高,即使某些序列与人类版本的相似度低于25%。
这项成果为蛋白质工程带来重要启示。当前,研究人员在设计酶类药物时,往往需要通过大量实验逐一筛选略有不同的变体,过程缓慢且成本高昂。借助新模型,他们可在计算机中同时测试多个设计方案,极大提升研发效率。
特别声明:本文转载仅仅是出于传播信息的需要,并不意味着代表本网站观点或证实其内容的真实性;如其他媒体、网站或个人从本网站转载使用,须保留本网站注明的“来源”,并自负版权等法律责任;作者如果不希望被转载或者联系转载稿费等事宜,请与我们接洽。