中国科学院上海药物研究所研究员段佳团队联合徐华强团队,首次通过高分辨率冷冻电镜技术解析了猪源非洲爪蟾源促性腺激素释放激素受体(GnRHR)与哺乳动物内源性促性腺激素释放激素(GnRH)及Gq蛋白的激动态复合物结构,并揭示了GnRH的保守识别机制和受体激活的分子基础,为开发新一代生殖疾病和癌症治疗药物提供了关键结构模板。6月17日,相关研究发表于美国《国家科学院院刊》。
GnRHR是下丘脑-垂体-性腺轴(HPG)的核心受体,通过调控促性腺激素(LH和FSH)的分泌控制生殖功能,其异常激活或抑制与不孕症、性早熟、子宫内膜异位症和前列腺癌等疾病密切相关。GnRHR广泛存在于几乎所有脊椎动物中,精密调控着动物的生殖平衡,但其识别激素信号并激活下游通路的机制尚不清楚。此外,GnRH激活 GnRHR的结构信息长期缺失,阻碍了靶向药物的理性设计。
研究团队通过跨物种序列比对发现,非哺乳动物的GnRHR通常保留有典型的Helix 8结构,而哺乳动物中则普遍缺失该结构域。由此研究团队筛选了两种与人源GnRHR具有代表性差异的物种,分别为与人源GnRHR序列同源性高达91.2%的猪源GnRHR(pGnRHR),以及与人源序列差异较大的非洲爪蟾GnRHR(fGnRHR)。
研究团队成功解析了GnRH激活状态下,pGnRHR和fGnRHR分别与Gq蛋白结合形成的复合物冷冻电镜结构。结构研究显示,GnRH在两种复合物中均以独特且保守的“倒U形”构象嵌入受体正构口袋,其N端与C端分别插入受体口袋的不同区域,并与跨膜螺旋及胞外环上的关键残基形成特异性相互作用。该结合口袋周围的关键残基具有高度保守性,同时特定物种(如fGnRHR)在ECL3构象上具有的差异,提示该区域可能参与了功能精细调控的进化适应。功能实验同样证实了保守残基对GnRH诱导的信号传导具有显著影响。
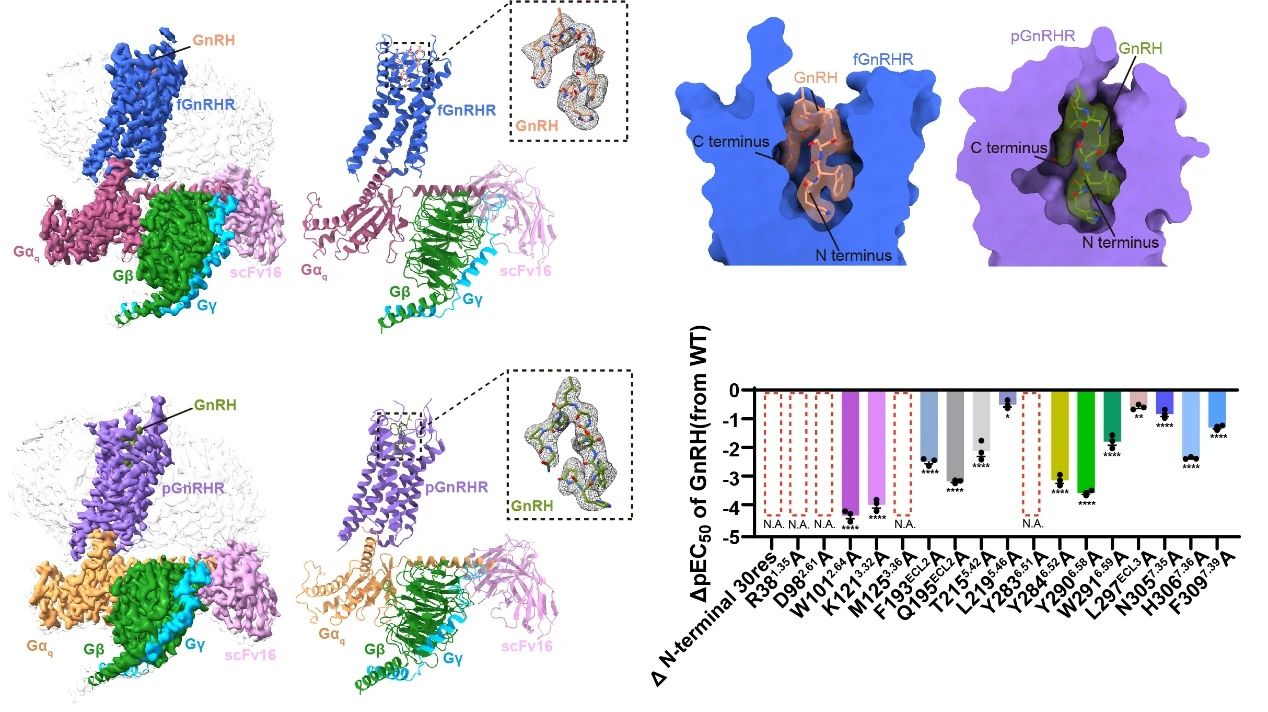 GnRH与非洲爪蟾源以及猪源GnRHR-Gq复合物的冷冻电镜结构。图片由研究团队提供
GnRH与非洲爪蟾源以及猪源GnRHR-Gq复合物的冷冻电镜结构。图片由研究团队提供
?
基于激动态结构,研究团队进一步构建并分析了9种已上市GnRH类似物的受体结合构象,发现多肽中第6位甘氨酸被D型氨基酸取代,可显著增强其“预折叠”能力,稳定其激动构象,进而提高药物活性并增强突变耐受性。
研究团队表示,本项研究填补了GnRHR激活机制的结构空白,为新一代小分子与多肽药物的结构优化与创新开发提供了坚实基础。未来,依托该结构信息与构效规律,有望开发出更安全、更稳定、作用更精准的GnRH类药物,为广大不孕症与激素相关肿瘤患者带来福音。
相关 :https://doi.org/10.1073/pnas.2500112122
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。