近日,松山湖材料实验室生物界面团队与纳米生物材料团队合作,在单分子尺度研究领域取得重要突破,首次揭示了质子化调控的pHLIP(pH低插入肽)构象转变及跨膜动力学过程。相关成果已发表于《美国化学学会纳米杂志》(ACS Nano)。
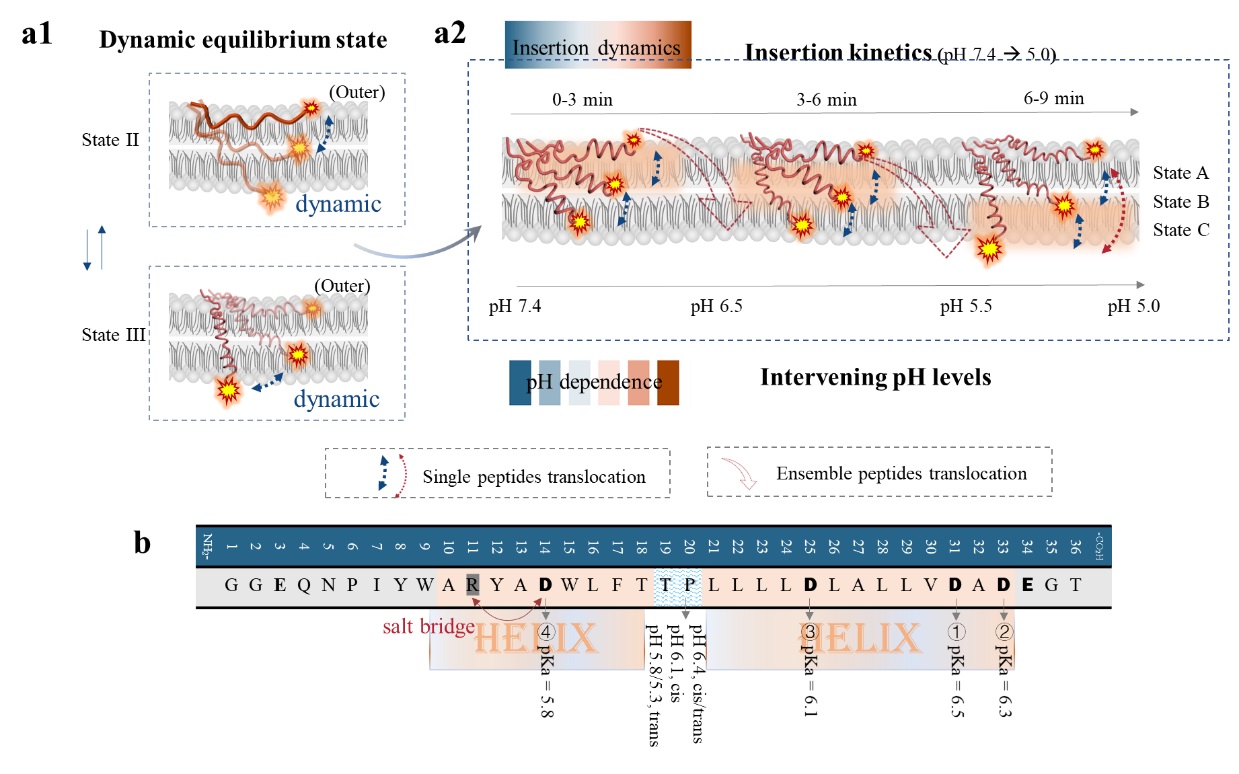 质子化驱动pHLIP构象变化及插膜动力学过程示意图。研究团队供图
质子化驱动pHLIP构象变化及插膜动力学过程示意图。研究团队供图
?
细胞膜与内源性和外源性分子的复杂相互作用是多种生物过程的基础,也为医疗发展提供了重要依据。其中,pHLIP多肽因其独特的pH响应特性成为研究分子跨膜机制的理想模型——它能在不破坏膜结构的情况下实现跨膜插入,在癌症诊断和药物递送领域具有广阔应用前景,目前多个变体已进入临床前测试阶段。
近期,针对pHLIP跨膜插入途径的研究虽取得一定进展,利用停流圆二色谱、荧光光谱和固态核磁共振等技术,揭示了插入过程中的“中间态”及pH依赖的“热力学中间态”,但这些系综技术存在局限性,难以精确定位膜内中间态的位置、停留时间及其与热力学态的关联,更无法捕捉单个肽分子的动态变化。
为攻克这一难题,研究团队依托近年来发展的单分子荧光技术,首次在单分子尺度上揭示了质子化调控的pHLIP构象转变及跨膜动力学过程。他们通过实时追踪野生型pHLIP及其三种变体的跨膜转运,鉴定出三种膜内"亚稳态构象",并阐明了这些构象在插膜过程中的动态转换机制。研究发现,这些转变源于质子化肽与脂质微环境的相互作用,且可通过C端可质子化残基进行调控。
该研究成果不仅揭示了残基质子化对分子构象及其跨膜动力学的重要影响,更为药物递送系统设计提供了全新的思路和方向。
相关论文信息:https://doi.org/10.1021/acsnano.4c18301
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。