近日,北京协和医院肝脏外科研究员杨华瑜、基本外科主任医师康维明团队通过创新构建患者来源的3D生物打印胃癌模型,可精准复刻胃癌组织学特征、基因组图谱及药效反应性,具有快速、低成本、高保真优势。该模型有望改变胃癌化疗方案依赖经验选择的现状,为精准治疗提供可靠工具。相关研究发表于Molecular Cancer。
胃癌是全球第五大常见恶性肿瘤,有显著的肿瘤异质性。传统预测手段难以精准预估疗效,现有的患者来源类器官和异种移植模型,面临成本高、批次效应明显等局限。
为突破这一困境,研究团队首先制备出合适的“打印墨水”。通过反复筛选不同水凝胶,团队发现6.25%明胶甲基丙烯酰酯+0.5%透明质酸甲基丙烯酰酯的生物墨水不仅具备理想的力学性能,又能完美模拟胃癌细胞生存的细胞外基质环境。随后,团队筛选出33个体积充足且无微生物污染的组织样本,成功地“打印”出3D生物打印胃癌模型。
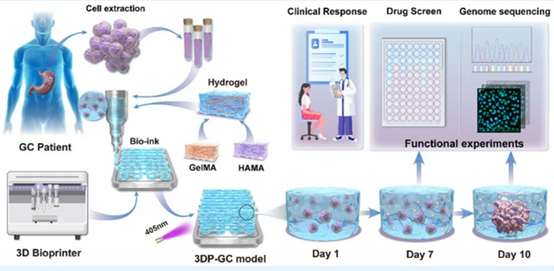 3D生物打印胃癌模型制备流程及其在患者临床药物反应预测中的应用示意图
3D生物打印胃癌模型制备流程及其在患者临床药物反应预测中的应用示意图
研究人员表示,该模型完整保留了原发肿瘤的关键特征。全外显子测序发现,其与原发肿瘤在单核苷酸变异上高度同源,APC突变100%保留,TP53、RNF43等复发突变也与原发肿瘤一致,稳定维持了患者肿瘤基因组特征。
此外,该模型在药物测试中同样表现亮眼。对5-氟尿嘧啶、奥沙利铂等一线化疗药的筛选显示,模型的药物敏感性与患者临床治疗结果显著相关,可用于区分药物敏感与耐药患者。该模型同时还展现出靶向治疗的筛选潜力。对HER2和VEGFR2阳性模型的测试显示,靶向药的抑制效果与靶点表达水平高度相关,小分子酪氨酸激酶抑制剂则表现出更明确的浓度依赖性抑制作用,为靶向治疗方案选择提供了参考。
相比构建传统的异种移植模型需要数月,该模型建模仅需一周左右;成本低且可批量生产,适合高通量药物筛选;能够保留肿瘤微环境中的基质细胞和免疫细胞。随访显示,模型预测结果与12名新辅助化疗患者、5名辅助化疗患者的临床结局高度吻合。
杨华瑜表示,团队将继续整合多组学技术与人工智能算法,优化生物墨水配方与药物组合预测,希望为恶性肿瘤个体化治疗开辟新路径。
相关论文信息:https://doi.org/10.1186/s12943-025-02466-9
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。