|
|
|
|
|
北大团队3届博士10年接力,完成一个“终极挑战”! |
|
|
看着发表在《自然-合成》上的研究工作,雷晓光心中的自豪油然而生:那个天然产物合成领域的“巅峰难题”“终极挑战”,终于被他们攻克了。
10年前,35岁的雷晓光挥别工作6年的北京生命科学研究所(简称北生所),回到母校北京大学。
他原本的专业领域是化学合成,也就是在实验室中,通过化学手段制造出自然界存在的物质,或者创造出世界上原本没有的物质。但在北生所的经历,让他看到了化学生物学与生物合成、生物催化这些新兴领域的巨大潜力。因此,他建立起一个特殊的课题组:一半人员是化学背景,另一半人员则来自生命科学以及医学、药学等专业。
也是在那段时间,他看中了一种独一无二的天然产物,心心念念地想把它合成出来。当时他并没有料到,这是一条多么艰难曲折却又意味深长的路。

这个耗时10年、让雷晓光团队3批优秀博士生前赴后继的课题,就是Alchivemycin A的全合成。
2012年,一个日本科学家团队从链霉菌的分泌物中,分离得到了一种天然产物,并将其命名为Alchivemycin A。这种天然产物具有很好的抗肿瘤和抗生素活性,一时间引起了国际同行的关注。
然而直接从自然界中获得的Alchivemycin A太过稀少,全世界大概也只有几毫克,几乎无法支持进一步的科学研究。
每当这种情况出现时,合成科学(包括合成化学和合成生物学)的重要性就凸显出来。几百年来,人工合成的物质从方方面面改变了人类社会的面貌。例如人们使用的小分子药物中,就有超过70%是合成而来的。很多稀有珍贵的复杂天然化合物,如紫杉醇等,也需要通过合成科学的手段扩大生产,才能满足人们的需要。
但Alchivemycin A的合成,不是一般的难,因为它拥有一个非常奇特的结构:2H-tetrahydro-4,6-dioxo-1,2-oxazine(TDO)杂环。这是一个6元环,在环上的碳原子和氮原子中间,插入了一个氧原子。迄今为止,人们没有在第二种天然产物中看到过这样令人匪夷所思的结构。而偏偏这个杂环,是一个重要的药效团。
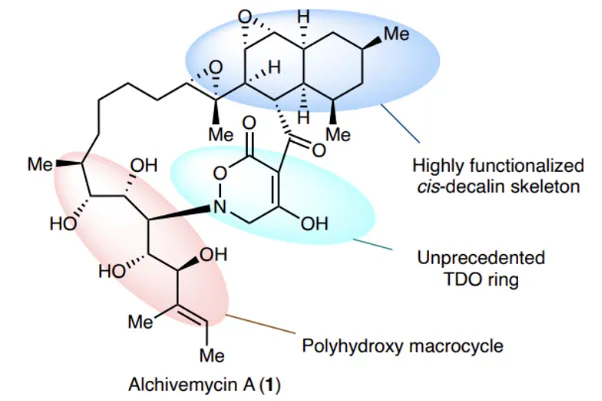
Alchivemycin A化学结构,中间部分为TDO杂环
“这几乎是自然界中最独特、最复杂的分子之一了。对合成科学家来说,可以说是终极挑战。”雷晓光说,他喜欢挑战。
雷晓光课题组先后派出两位非常优秀的博士生领衔攻关,却都没能拿下这个难题。
如今已经在西湖大学任职的洪本科,是这场接力跑中的“第二棒选手”。2016年,也就是他读博的最后一年,雷晓光建议他从已经毕业的师兄廖道红博士那里接过这块“难啃的骨头”。他坦言,当时“心里咯噔了一下”。

Alchivemycin A的合成大致可以分为3步:先分别合成两个片段,再把这两个片段通过构建TDO杂环连接起来。之前廖道红等人已经合成出了一边的多羟基侧链。洪本科又花了一年多时间,把另一边顺式十氢萘片段也合成出来了。
但在构建TDO杂环这一步,他卡住了,即便尝试了当时能用的大多数方法,还是没能成功。
“先放一放吧。”雷晓光对洪本科说,“也许未来会有更好的方法。”
南京大学生命科学学院的戈惠明教授团队在JACS和《自然-通讯》两本期刊上接连发表的两篇论文,让雷晓光看到了希望的曙光。
原来,这个团队也在关注Alchivemycin A这个结构异常复杂的分子。但与雷晓光团队主要采用化学合成手段不同,他们是从生物合成的方法入手的。
通过与一个日本团队的合作,戈惠明课题组拿到了生产Alchivemycin A的产生菌株。利用这个菌株,他们找到了复杂Alchivemycin A形成的生物合成基因簇,特别是编码了6个氧化还原酶,负责该分子形成过程中的六步氧化修饰;此外还发现了一种独特的黄素依赖型氧化酶,能催化TDO杂环的形成。
“在全合成的Alchivemycin A中,单靠化学的方法,会遇到重大卡点;单靠生物学的方法,也无法完成合成需要的全部流程。但如果我们把化学的方法和生物的方法结合在一起,会不会就可以了呢?”雷晓光这样想着,立刻联系戈惠明团队,拿到了这些关键酶。
这一次,他选择了两名本科毕业不久的直博生,跑这场漫长接力赛的第三棒。他们就是此次发表论文的两位共同一作:1998年出生的董浩然和1999年出生的郭念昕。在雷晓光这个强调学科交叉的课题组里,董浩然钻研化学合成,郭念昕主攻生物合成。

尽管这是“传说中的难题”,但两个年轻人很痛快地接受了挑战。
董浩然要做的第一个关键实验,是观察戈惠明课题组提供的天然酶能不能和雷晓光课题组通过人工合成得到的底物进行反应。在大家紧张的等待中,实验结果出来了,他们既高兴又失望。
高兴的是,天然的酶与非天然的底物确实能发生反应;失望的是,反应转化率太低了,还不到10%。
在这个基础上,郭念昕对原有的天然酶进行了设计改造,筛选出能在较低温度下进行反应的、活性更好的突变酶,一举将反应转化率提升至接近100%。

就这样,两个年轻人利用改造完善后的酶,经过3步精准的氧化反应,在世界上首次人工构建出了TDO杂环结构。
论文发表后,《自然-合成》以专题形式对这项工作进行重点推荐,并撰写了评述报道。国际著名酶催化研究专家,美国得克萨斯大学教授Rudi Fasan如此评价道:“这项整体工作是全合成的杰作,它很好地说明了化学合成与酶催化能够在合成复杂分子的目标中充分结合。”
他最熟悉的合成化学领域,迄今已经发展了200余年。尽管技术越来越成熟、方法越来越完善,但在自然界复杂精妙的造物面前,还是常常束手无策。
这时,“年轻”得多的合成生物学学科,就展现出了巨大的优势。酶,这种在生命体中诞生的催化剂,是大自然在漫长进化中千锤百炼的产物。它们往往能在温和的条件下,以非常高效、环保、精巧的方式完成一些传统方法中极其复杂苛刻的反应。
在这项研究中,戈惠明团队从菌株中获取的6个氧化还原酶和1个大环化酶,在TDO杂环的构建中发挥了关键作用。这充分表明,大自然提出的挑战,最终能在大自然中找到解法。
“不管黑猫白猫,能抓住老鼠就是好猫。同样的,不管是合成化学还是合成生物学,只要能得到我们想要的产物,就是好的方法。”雷晓光对《中国科学报》说,“而这项工作最迷人的地方,就在于单纯用化学合成或者生物合成的方法都无法实现目标。只有化学家和生物学家互补协作,像接力跑一样跨过各自的障碍,才能抵达终点。”
戈惠明则笑道:“我想,合成化学家和合成生物学家是天然的好搭档。”
在化学合成与生物合成协同创新的方向,雷晓光课题已经深耕了近10年。近日,他们还应邀在Accounts of Chemical Research杂志上发表了题为“Hunting for the Intermolecular Diels?Alderase(寻找分子间的D-A反应酶)”的综述文章。
D-A反应是有机合成化学中最常见的经典反应之一,其中包括单个分子内的D-A反应和分子间的D-A反应。在很长一段时期内,化学家发现的D-A反应酶绝大多数只能催化分子内反应,无法催化分子间反应。
雷晓光课题组从2014年起就开始“猎寻”自然界中独特的分子间D-A反应酶。经过多年的努力,他们于2020年从桑树的愈伤组织中“钓”出了世界上第一个分子间D-A反应酶,相关工作发表在《自然-化学》上。
同时,由于这项开拓性的科研工作,雷晓光捧得了腾讯科学探索奖和MDPI屠呦呦奖。这次能成功合成Alchivemycin A,离不开他在相关酶催化与化学酶法合成领域的长期积累。
“我们将持续致力于解决生物催化中的核心科学问题,扩大酶催化工具箱,从而实现更多酶催化的有机化学反应。”雷晓光说。
https://doi.org/10.1038/s44160-024-00577-7
https://doi.org/10.1038/s41467-022-32088-4
https://doi.org/10.1021/jacs.1c00516
https://pubs.acs.org/doi/10.1021/acs.accounts.4c00315
https://www.nature.com/articles/s41557-020-0467-7
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。