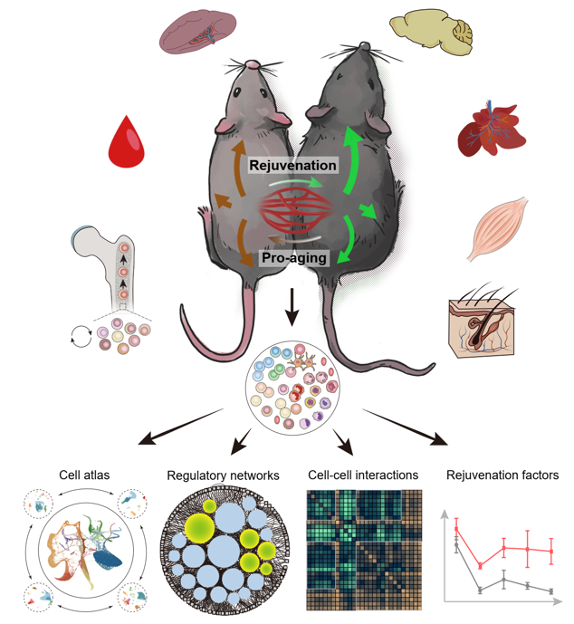
年轻血液促进机体多组织年轻化的系统生物学研究。 图源自论文
年轻血液能否诱导衰老组织的再生?能否促进衰老器官的“年轻化”?
5月24日,中科院动物研究所研究员刘光慧课题组、研究员曲静课题组,中科院北京基因组研究所研究员张维绮课题组等合作的一项发表于《细胞—干细胞》上的研究证实,上述想法并非“无稽之谈”。
研究者通过构建异体共生模型,使年老小鼠和年轻小鼠的血液“互通互换”,5周后,年老个体多个组织的衰老标志物显著降低。
两两配对,异体共生
对于一批长到2岁(相当于人类的65-70岁)的小鼠而言,一定没想到有生之年还能“重返青春”。
年轻和年老小鼠两两配对,被研究人员构建起了异体共生模型。简言之,就是通过外科手术,将两个不同年龄、身处不同健康状态的动物连接到一起,使它们分享共同的血流。这是最早于1864年由法国动物学家Paul Bert发展出来的一种共享循环系统的模型,以此来研究血液中到底是哪种物质会影响健康。
异体共生模型一旦建立,血液便可相互贯通。
理论上来说,全身的器官和组织都可以受到“异体共生”的影响,但由于科学聚焦,研究人员主要选取了脑、肝脏、骨骼肌、皮肤、骨髓、脾脏及外周血7种组织器官进行深入解析。
年老者“重返青春”,年轻者“少年老成”
利用单细胞转录组测序技术,他们揭示了异体共生引起的年老和年轻个体的细胞“年龄”的全景变化规律。
研究发现,血液交换之后,年老小鼠呈现出了典型的“年轻化”改变。主要表现为衰老组织微环境的改善及相应干细胞的激活。也就是说,年轻的血液环境,激活了年老小鼠骨髓、皮肤等组织器官中已经老化、受损、衰竭的干细胞。
其中,反应最强烈细胞类型之一是骨髓中的造血干细胞。在持续不断的年轻态血液的“浸泡”下,年老造血干细胞的基因表达特征变得更接近于年轻的状态。
另一方面,到了年轻小鼠这边,却略显辛酸。原本正是精力旺盛、活力无限的年龄,却呈现出一种违和的“老成”:不同器官、组织和细胞类型呈现出加速衰老的特征。
“结合差异基因表达、核心调控转录因子和细胞-细胞间通讯分析等方法,我们发现了一系列以表观调控基因YY1以及细胞趋化因子CCL3为代表的造血干细胞衰老调控因子。”本研究共同第一作者,中科院动物所、北京干细胞与再生医学研究院“致一”研究员马帅对《中国科学报》说。
他表示,正是由于发现了这些“延缓衰老”的基因密码,如果未来能够针对这些调控因子设计相关的干预策略,或许可以帮助人们延缓衰老、预防老年疾病的发生。同时,这面临着非常多的挑战和问题。
为什么会这样?不同组织器官有差别吗?
在异体共生系统中,必须要提的还有随着血液交换流动的细胞。就好比在两块土地间打通了河流,种子就随之流动一样,两个个体间的细胞也许会发生彼此交换,到达各个组织器官。
那么,究竟是血液环境的改善,还是年轻小鼠细胞的到来,使得年老小鼠变“年轻”了呢?
再进一步追问,是血液大环境改善后,年老小鼠本身的细胞由于得到了滋养而变得更具活力了?还是看到了“外来和尚”使得年老小鼠自身的细胞感受到了“压力”或“危机”,而奋发图强了呢?亦或年老小鼠本身的细胞选择了“躺平”,只靠外界血液环境和外来的年轻细胞达到组织器官“年轻化”的结果?
这些细胞间的相互作用复杂多变,必须通过精巧的实验设计和技术手段才能探寻一二。
“我们用CD45.1和CD45.2两种不同基因型为标记来区分异体共生年老和年轻小鼠的细胞,不仅通过流式技术分析了不同基因型个体来源的造血免疫细胞,还进一步构建了CD45不同基因型小鼠异体共生的单细胞转录组图谱。”本文的共同第一作者、首都医科大学宣武医院研究员王思说。
研究结果显示,异体共生系统中,外周血和脾脏细胞的互通程度较高;而骨髓中的造血干细胞互通程度却很低,年轻个体中的造血干细胞仅有不到1%来源于年老个体,年老个体中年轻来源的也少于5%。
“这提示着,年老小鼠的骨髓造血干细胞发生了一种受到年轻血液影响后的内源性变化。”马帅说,“此外,除了造血免疫系统,年老个体的外周实体组织也会被年轻血液‘年轻化’。”
值得一提的是,研究人员还发现,Gilz,一个具有抗炎活性的因子,在不同组织细胞中的表达改变可能是系统衰老和年轻化的关键调控因素。
换血≠输血,“输血续命”不可取
“该研究从系统生物学角度揭示了衰老的生物学机制,也为建立衰老的科学评估方法、寻找衰老的干预靶点及干预策略提供了重要的数据资源和线索思路,在科学防控人口老龄化方面具有广阔的应用前景。”第三军医大学大坪医院(陆军特色医学中心)神经内科主任、教授王延江表示。
同济大学生命科学与技术学院副院长、教授岳锐表示,“该研究为深入理解异体共生系统中衰老和年轻化机制提供了宝贵的单细胞资源,同时为干预和延缓机体衰老提供了一系列潜在的新靶点。”
作者指出,本项研究中的“血液互换”和“输血”是两种概念,目前并没有明确证据能表明,输入年轻血液可以延长动物或人的寿命,这种做法也是不可取的。
即便是异体共生实验,本项研究也仅深入解析了小鼠的7个组织器官,这与人们通常理解的全身试验还有较大差距。从小鼠到人体,从分子机制到干预手段开发以及临床试验,还有很长的路要走。
相关论文信息:https://doi.org/10.1016/j.stem.2022.04.017
版权声明:凡本网注明“来源:中国科学报、科学网、科学新闻杂志”的所有作品,网站转载,请在正文上方注明来源和作者,且不得对内容作实质性改动;微信公众号、头条号等新媒体平台,转载请联系授权。邮箱:shouquan@stimes.cn。