



由左至右:William G. Kaelin Jr, Sir Peter J. Ratcliffe和Gregg L. Semenza
(图片来源:诺贝尔奖官网)
北京时间2019年10月7日17点30分,2019年诺贝尔生理学或医学奖揭晓,来自美英的三位科学家William G. Kaelin Jr, Sir Peter J. Ratcliffe和Gregg L. Semenza获奖,获奖理由是“发现了细胞如何感知和适应氧气的可用性”。
威廉·凯林(William G. Kaelin Jr)为美国癌症学家,彼得·拉特克利夫(Sir Peter J. Ratcliffe)为英国医学家,格雷格·塞门扎(Gregg L. Semenza)为美国医学家。
动物需要氧气才能将食物转化为有用的能量。数个世纪前,氧气最基本的重要性已被认识到,但长期以来人们一直不清楚细胞如何适应氧气水平的变化。
William G. Kaelin、Sir Peter J. Ratcliffe和Gregg L. Semenza发现了细胞如何感知并适应氧气变化的含量。他们发现了调控基因活性的分子机器,从而响应于不同水平的氧气。
今年诺贝尔奖获得者做出的开创性发现揭示了生命最重要的适应过程之一的作用机制。他们为我们了解氧水平如何影响细胞代谢和生理功能奠定了基础。他们的发现也为抗击贫血、癌症和许多其他疾病的新策略铺平了道路。
氧气站上舞台中央
氧气(O2)约占地球大气层的五分之一。氧气对动物生命至关重要,为了将食物转化为有用的能量,几乎所有动物细胞中的线粒体都会利用氧气。1931年诺贝尔生理学或医学奖得主Otto Warburg,揭示了这种转换是一种酶催化的过程。
在进化过程中,相关机制得以进化,从而确保了对组织和细胞的充分供氧。颈动脉体(靠近颈部两侧的大血管)含有专门的细胞来感应血液中的氧气含量。1938年的诺贝尔生理学或医学奖授予了Corneille Heymans,以表彰其发现了颈动脉体如何感知血氧,从而直接与大脑交流来控制呼吸频率。
缺氧诱导因子(HIF)步入舞台
除了对低氧气水平(缺氧)进行颈动脉体调控的快速适应外,还有其他一些基本的生理适应。对缺氧的关键生理反应是促红细胞生成素(EPO)激素水平的升高,这会导致红细胞产量的增加(促红细胞生成)。激素调控红细胞生成的重要性在20世纪初就已为人们所知,但是这种过程本身如何由O2控制仍然是个谜。
Gregg Semenza研究了EPO基因,以及其如何受变化的氧气含量所调控。通过使用基因修饰小鼠,位于EPO基因旁边的特定DNA片段被发现参与介导对缺氧的反应。Sir Peter Ratcliffe也研究了EPO基因的O2依赖性调节;并且两个研究小组都发现,不仅在通常产生EPO的肾细胞中,几乎所有组织中都存在氧感知机制。这些重要发现表明,该机制在许多不同的细胞类型中通用并且发挥功能。
Semenza想要鉴定介导这种反应的细胞成分。在培养的肝细胞中,他发现了一种蛋白质复合物,该复合物以一种氧依赖性的方式与已鉴定的DNA片段结合。他称这个复合物为缺氧诱导因子(HIF)。他付出了大量的努力去纯化HIF复合物;在1995年,Semenza发表了他的一些关键发现,包括鉴定编码HIF的基因。HIF被发现由两种不同的DNA结合蛋白组成,即所谓的转录因子,现在称为HIF-1α和ARNT。现在,研究人员终于可以开始解决这个难题,让他们能够去了解这里面还包含别的什么组成,以及这个分子机器如何工作。
VHL:意料之外的“舞伴”
当氧气水平很高时,细胞中几乎不含HIF-1α。但是,当氧气水平低时,HIF-1α的量会增加,因此它可以结合并调节EPO基因以及其他具有HIF结合DNA片段的基因。几个研究小组表明,通常会迅速降解的HIF-1α在缺氧条件下可不被降解。在正常的氧气水平下,一种被称为蛋白酶体的细胞机器会降解HIF-1α;Aaron Ciechanover、Avram Hershko和Irwin Rose因发现蛋白酶体被授予2004年的诺贝尔化学奖。在这种情况下,将一种小肽(泛素)连接到HIF-1α蛋白上。泛素是将蛋白质运送到蛋白酶体进行降解的标签。泛素如何以氧依赖性方式结合HIF-1α仍然是一个核心问题。
这个问题的答案来自一个意想不到的方向。大约在Semenza和Ratcliffe探索EPO基因的调控的同时,癌症研究人员William Kaelin, Jr.正在研究一种遗传综合征,即希佩尔-林道综合征(VHL病)。这种遗传疾病会导致遗传性VHL基因突变的家庭罹患某些癌症的风险急剧增加。Kaelin发现,VHL基因编码一种可预防癌症发生的蛋白质。Kaelin还发现缺乏功能性VHL基因的癌细胞会异常高水平表达低氧调节基因。但是VHL基因重新引入癌细胞后,恢复了正常水平。这是一个重要的线索,表明VHL以某种方式参与了对缺氧反应的控制。来自几个研究小组的其他线索表明,VHL是一个复合物的组分,这个复合物利用泛素标记蛋白质,而被标记的蛋白将会被蛋白酶体降解。然后,Ratcliffe和他的研究小组做出了一个关键发现:证明VHL可以与HIF-1α发生物理相互作用,并且是正常氧水平下HIF-1α降解所必需的。这一发现最终将VHL与HIF-1α联系到一起。
氧气改变平衡
许多拼图已经被放到了正确的位置,但是对O2含量如何调节VHL和HIF-1α之间相互作用的认知仍然缺乏。后续的研究瞄准了HIF-1α蛋白的特定部分,这个部分对于VHL依赖的降解很重要,并且Kaelin和Ratcliffe都怀疑O2感知的关键位于该蛋白结构域中的某个位置。 2001年,在两篇同时发表的文章里,他们发现,在正常的氧气水平下,羟基会被加到HIF-1α的两个特定位置(图1)。这种蛋白质修饰称为脯氨酰羟基化,使VHL能够识别并结合到HIF-1α,从而解释了正常的氧气水平如何通过对氧敏感的酶(即脯氨酰羟化酶)来控制HIF-1α的快速降解。Ratcliffe等人的进一步研究鉴定了负责这一过程的脯氨酰羟化酶。研究还表明,HIF-1α的基因激活功能受氧依赖性羟基化作用所调节。今年的诺奖得主至此阐明了氧气感应机制,并展示了其工作原理。
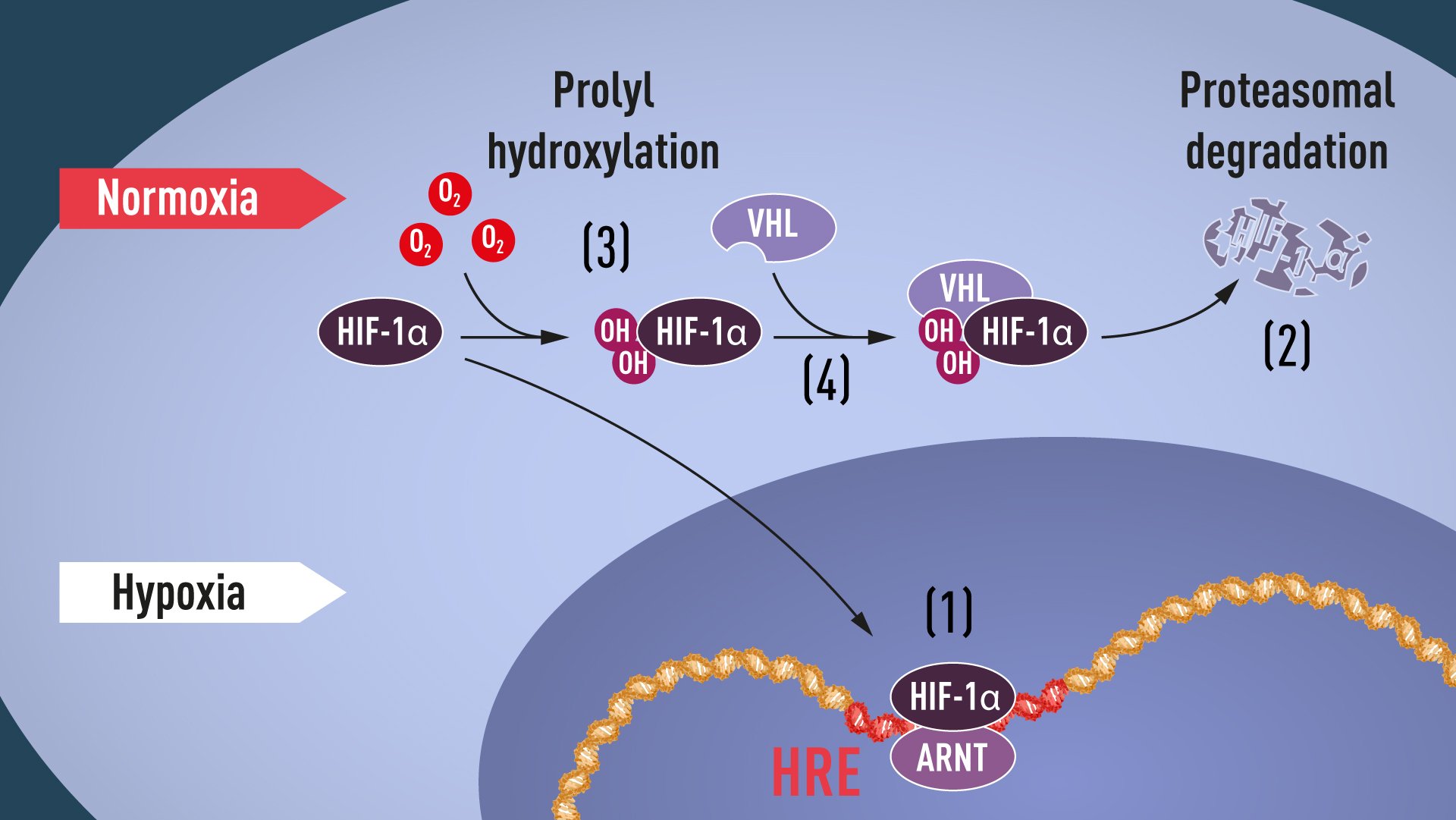
图1.当氧水平低时(缺氧),HIF-1α受到降解保护,并在核中聚集,它会与ARNT联合,并绑定到缺氧调节基因(1)中的特定DNA片段(HRE)。在正常氧水平下,HIF-1α则由蛋白酶体(2)快速降解。通过羟基团(OH)结合到HIF-1α(3),氧调节了这一降解过程。然后,VHL蛋白能够识别并与HIF-1α形成一个复合体,致使它以依赖氧的方式降解(4)。
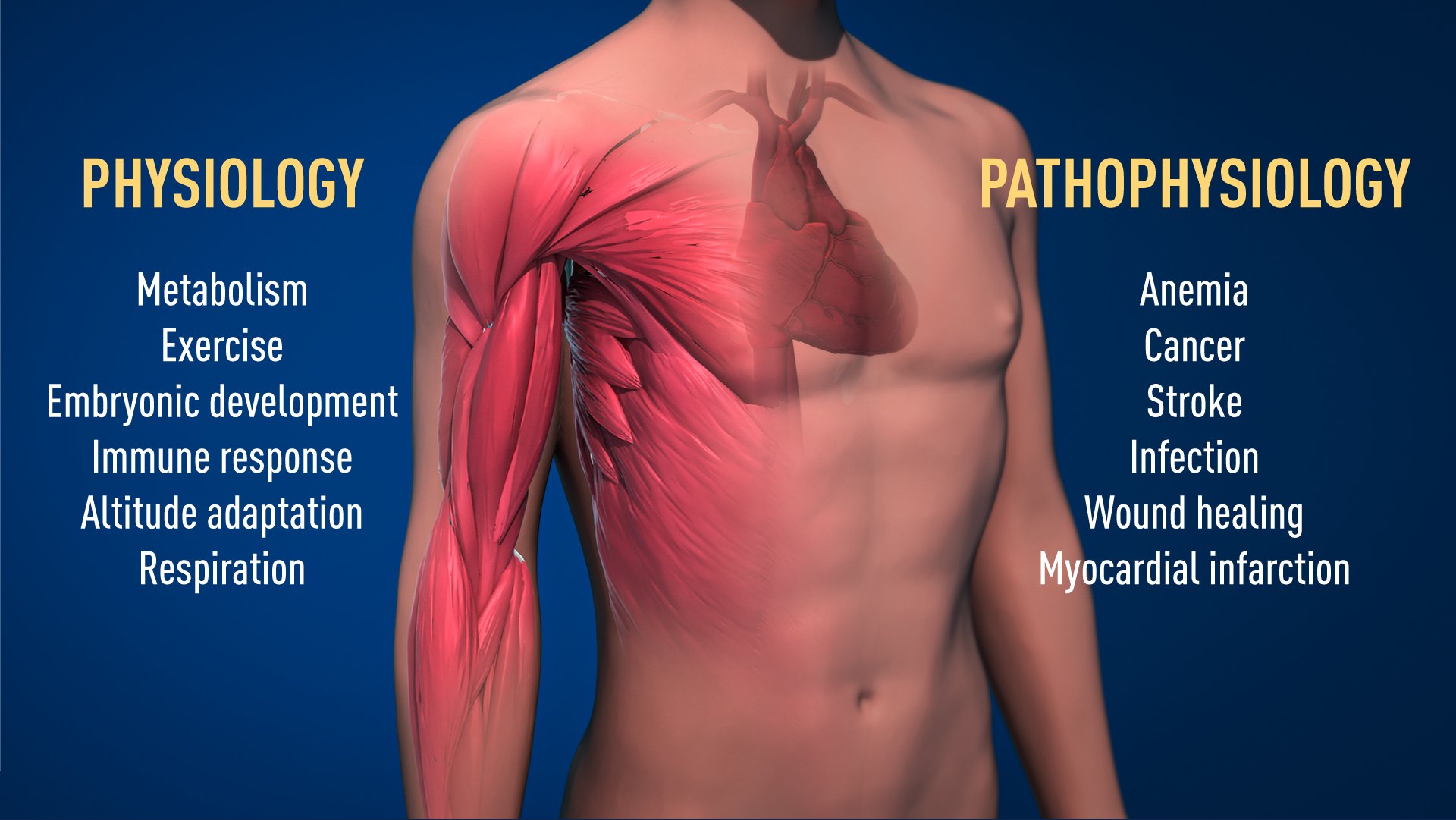
图2.获奖的氧气感受机制在生理学中有着基础性的重要性,比如我们的代谢、免疫反应和对锻炼的适应性。许多病理过程也受到影响。为了治疗贫血、癌症和其它疾病,研究人员正在努力研发能够抑制或激活氧气调节机制的新药物。
氧气塑造生理学和病理学
感谢今年诺奖得主的突破性工作,我们现在对于不同的氧气水平如何调节基础生理过程有了更多了解。氧感受让细胞代谢能够适应不同的氧气水平,比如肌肉在剧烈运动的时候。其他例子包括新血管生成和红细胞的产生。我们的免疫系统和许多其他生理功能同样受到这一机制的调节。有证据显示,氧感受对于胎儿发育也至关重要,它控制着正常的血管生成和胎盘发育。
氧气感受对许多疾病至关重要(图2)。例如,因为EPO表达减少,慢性肾衰竭患者经常严重贫血。EPO由肾细胞产生,对于控制红细胞产生极为重要。而且,氧气调节机制在癌症中也扮演了重要角色。在肿瘤中,氧气调节机制被用来刺激血管形成和重塑代谢,实现癌细胞的有效增殖。学术界和制药公司正在研发新药,通过激活或阻断氧气感受机制,从而介入到疾病的不同阶段。
更多阅读
孙学军科学网博文:氧气感受研究有望问鼎诺贝尔医学奖