对有机分子进行精确的分子编辑,迅速增加分子骨架的多样性和复杂性,避免复杂的多步从头合成及废弃物的产生,是现代有机合成的核心内容。近年来,化学家在C–H键官能团化(分子外围编辑)方面取得了巨大的进展,而直接修饰、改变分子核心骨架(分子骨架编辑)的进展则较为有限。用相同的化学试剂,同时对分子核心骨架和外围C–H键进行精确分子编辑的方法更是少之又少。
近期,东北师范大学毕锡和课题组以氟烷基苯磺酰腙原位生成高活性氟烷基卡宾为工具,通过反应条件的精细控制,实现了对吲哚核心骨架和外围碳氢键的精准分子编辑,高效制备了多种具有潜在医学用途的含氟氮杂环化合物。
2024年3月5日,相关成果以“Tunable molecular editing of indoles with fluoroalkyl carbenes”为题发表在Nature Chemistry期刊上。东北师范大学刘兆洪副教授和毕锡和教授为通讯作者,博士研究生刘少鹏、杨勇、宋清敏为共同第一作者。
吲哚是药物分子和天然产物中最常见的含氮杂环之一,在抗高血压、抗增殖、抗病毒、抗肿瘤、镇痛、抗炎、抗菌等多个治疗领域的药物中占有一席之地,被视为后期分子编辑的理想底物。含氟片段的引入往往能明显改变分子的物理、化学、生物学性质,即产生所谓的“氟效应”。因此,“氟引入”已成为药物、农药、新材料创制的常规策略。基于此,毕锡和教授团队以氟烷基-N-邻三氟甲基苯磺酰腙原位生产氟烷基卡宾中间体为工具,通过反应条件的精细控制,实现了对吲哚分子核心骨架和外围碳氢键的精准分子编辑,包括:吲哚骨架的“一碳”插入反应,2,3-位环丙烷化反应,3位C–H键偕二氟烯基化反应以及串联的环丙烷化/N–H键偕二氟烯基化反应,高效高选择性地制备了具有潜在药物用途的含氮杂环化合物,为构建含氟片段的复杂分子铺平了道路(图1)。
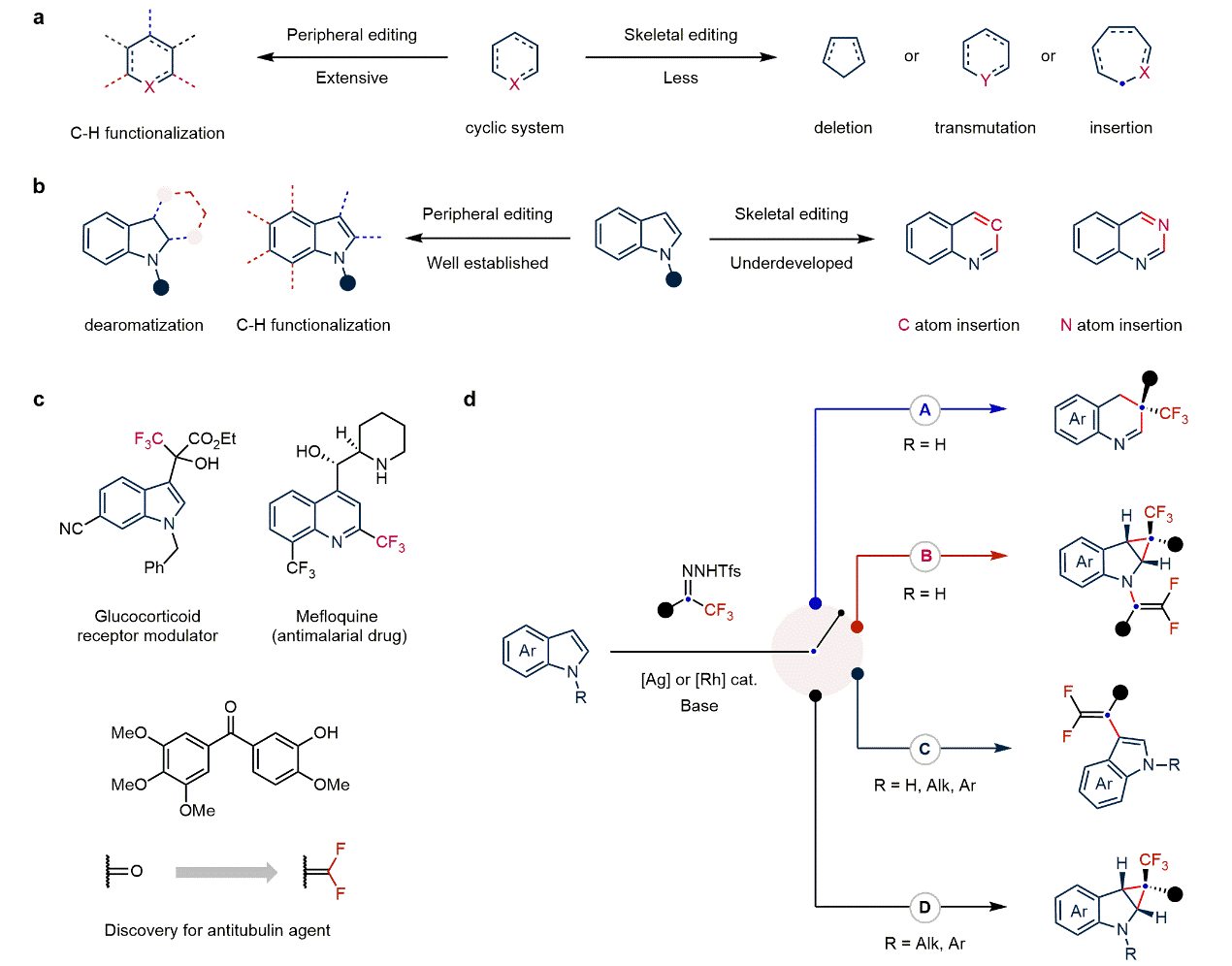
图1:研究背景和反应设计(图片来源:Nat. Chem.)。
吲哚是富电子芳烃,分子结构本身C3位和N1位均具有较高的反应活性,在与金属卡宾反应时可能会导致产生C2、C3位或N1位官能化产物和环丙烷化产物的混合物。为了实现N-无保护吲哚与氟烷基卡宾的发散性分子编辑,必须解决吲哚分子位点选择性和化学选择性问题。详细的反应条件优化显示,使用3倍量吲哚,TpBr3Ag(thf)为催化剂,在80 ºC反应以96%的产率获得吲哚“一碳”插入产物3。将吲哚降低至1倍量,N-邻三氟甲基苯磺酰腙提高至3倍量,在60 ºC反应以98%产量获得双官能化产物5。催化剂和碱对反应亦有影响,将银催化剂换为铑催化剂,有机碱氢化钠换为无机碱N,N-二异丙基乙胺时,以92%产量得到3位C–H键偕二氟烯基化产物4(表1)。
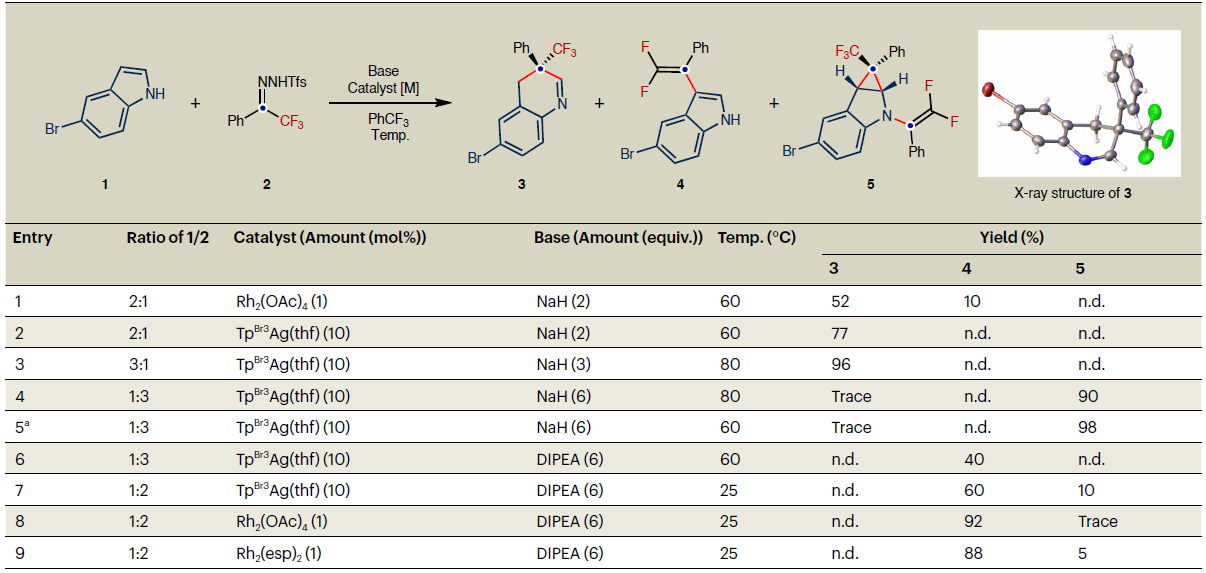
表1:反应条件优化(表格来源:Nat. Chem.)。
银催化氟烷基卡宾与吲哚“一碳”插入反应具有宽泛的底物适用范围和良好的官能团耐受性。各种拉电子基、给电子基以及杂芳环取代N-邻三氟甲基苯磺酰腙和吲哚均可以良好至优异的产率得到吲哚扩环产物。其中,全氟烷基链的引入,以及4-氮杂吲哚和6-氮杂吲哚的成功转化,将对新药研发起到促进作用。作者还发展了一锅/两步法,从吲哚出发快速合成具有季碳中心的四氢喹啉类化合物。为了验证该方法的高效性和实用性,作者进行克级规模实验,并对产物进行了一系列衍生化,得到了多种含三氟甲基的氮杂环化合物。
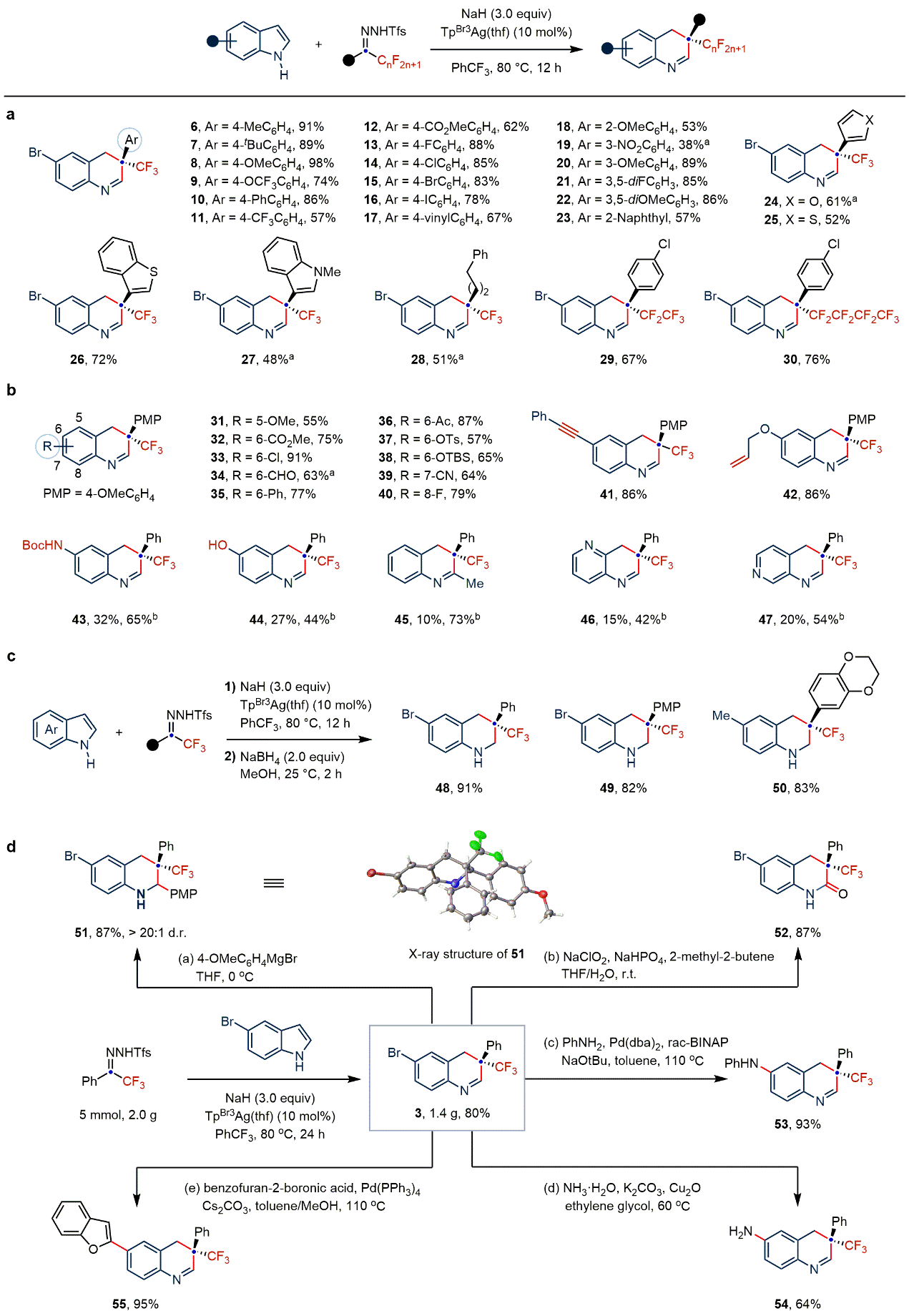
图2:氟烷基卡宾对吲哚骨架碳插入反应研究(图片来源:Nat. Chem.)。
随后作者对吲哚3位C–H键偕二氟烯基化,2,3-位环丙烷化以及双官能化反应的底物范围进行了详细的考察。如图3a所示,无论是对于N-未保护吲哚还是N-保护吲哚,含有不同取代基的N-邻三氟甲基苯磺酰腙均能够实现3位协二氟烯基化反应的高效转化。吡咯2位偕二氟烯基化产物的生成,进一步展示出了该方法的普适性。图3b显示,双官能化反应也显示出了较好的官能团耐受性。对于N-保护吲哚而言,除了3位的协二氟烯基化反应,同样可以实现2,3-位的去芳构化环丙烷化反应。图3c显示,无论是变换吲哚上的取代基,还是更替N-邻三氟甲基苯磺酰腙上的取代基,甚至是吲哚N原子上的保护基,如苄基、芳基、特戊酰基(Piv)、氨基甲酰基(CONMe2)、叔丁基二甲基甲硅烷基(TBS)等官能化基团均可以兼容到该反应体系当中。
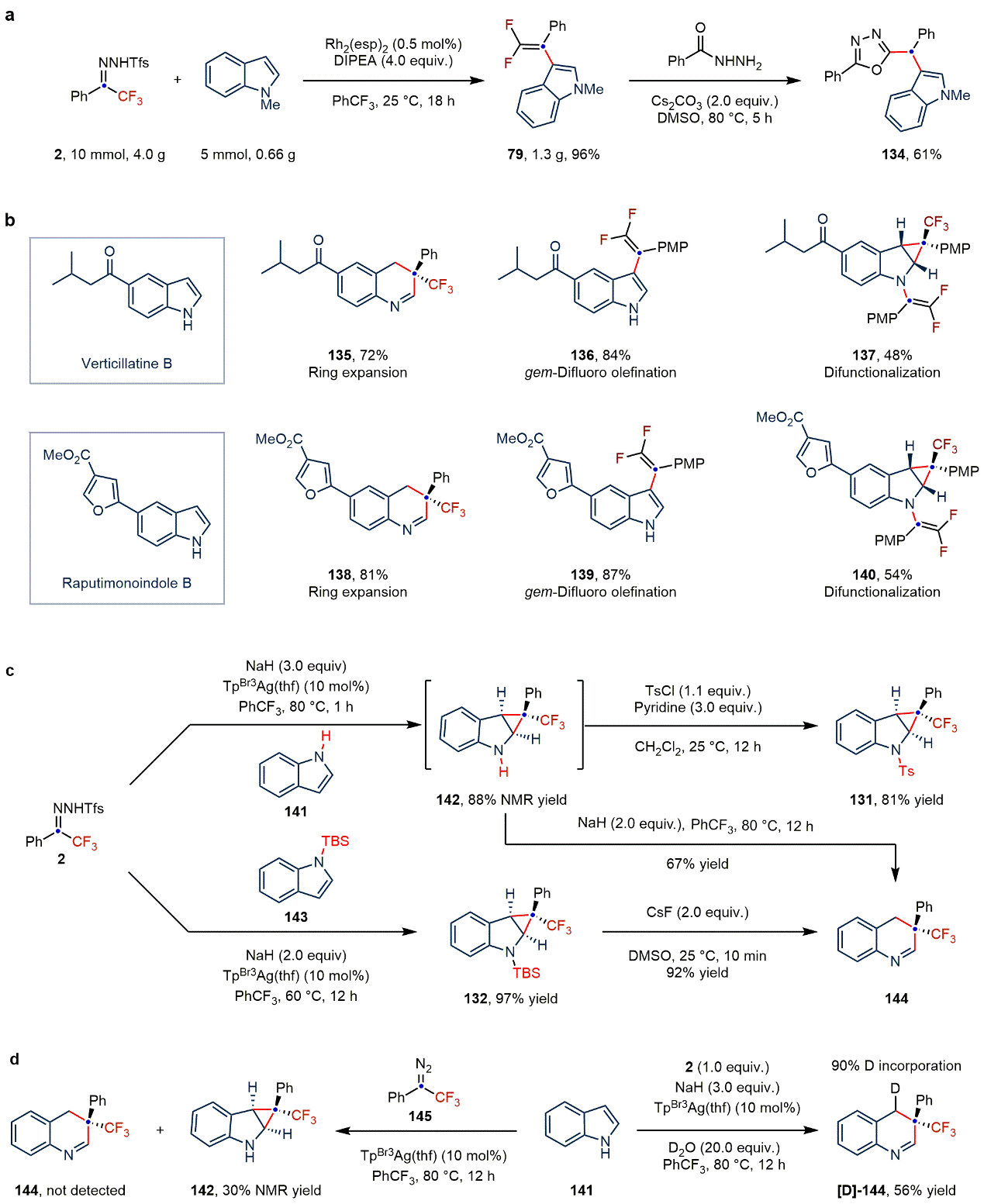
图3:氟烷基卡宾对吲哚的外围编辑反应研究(图片来源:Nat. Chem.)。
作者通过偕二氟烯基化产物与苯甲酰肼的环化反应,制备合成了2,5-二取代的1,3,4-恶二唑(134),展示了产物的潜在应用价值。鉴于吲哚的骨架编辑和外围编辑可能促进新药的研发,以及三氟甲基和偕二氟烯基在药物化学中的重要性,作者对两种从新热带植物中分离出来的天然产物verticillatine B和raputimonoindole B进行了多样性分子编辑反应,在不同的反应条件下,分别实现了两种天然产物的“一碳”插入反应、3位偕二氟烯基化反应,以及双官能化反应,为吲哚或喹啉类新药的开发提供了依据。
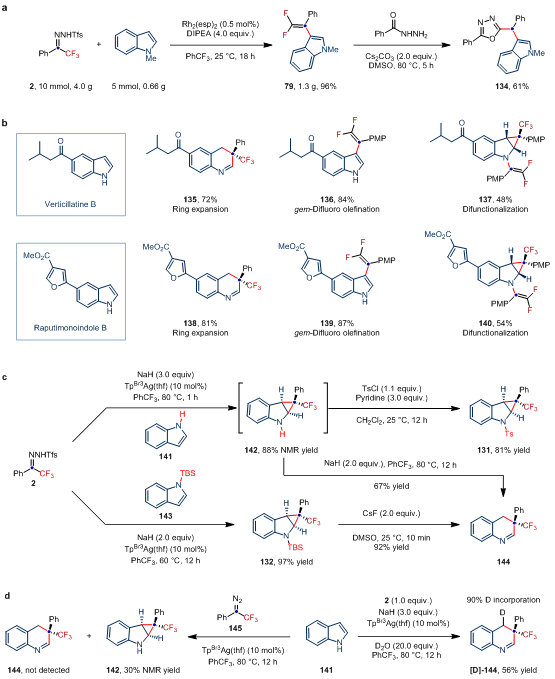
图4:衍生化实验、天然产物后修饰及机理验证试验(图片来源:Nat. Chem.)。
为了深入研究反应机制,作者进行了系列控制实验(图4c和4d)。实验表明,底物吲哚和N-邻三氟甲基苯磺酰腙在短时间内(1 h)可以生成环丙烷化产物。同时,N-TBS保护的环丙烷产物可在室温下脱除TBS基团进而转化为插碳产物。这些结果均表明,插碳反应过程可能经历环丙烷中间体。此外,实验表明NaH在开环反应过程中是必不可少的,反应溶剂中微量的水协助参与了质子化过程。
为了进一步探究反应机制,作者进行了理论计算研究。当使用Rh2(OAc)4-DIPEA催化体系时,DIPEAH+能够促进β-F消除过程优先发生,生成C3位偕二氟烯基化产物。该过程中DIPEA和F原子之间的氢键能够降低吉布斯自由能。而TpBr3Ag–NaH催化剂体系中不存在这种氢键效应,优先发生C2,C3位环丙烷化过程。当吲哚过量时,环丙烷中间体IntIII经过NaH拔氢,可逆开环以及水协助质子化过程,得到“一碳”插入产物。当N-邻三氟甲基苯磺酰腙过量时,形成动力学上有利的叶立德中间体IntIV1,再经历β-F消除过程得到双官能化产物,这与实验结果均保持一致。
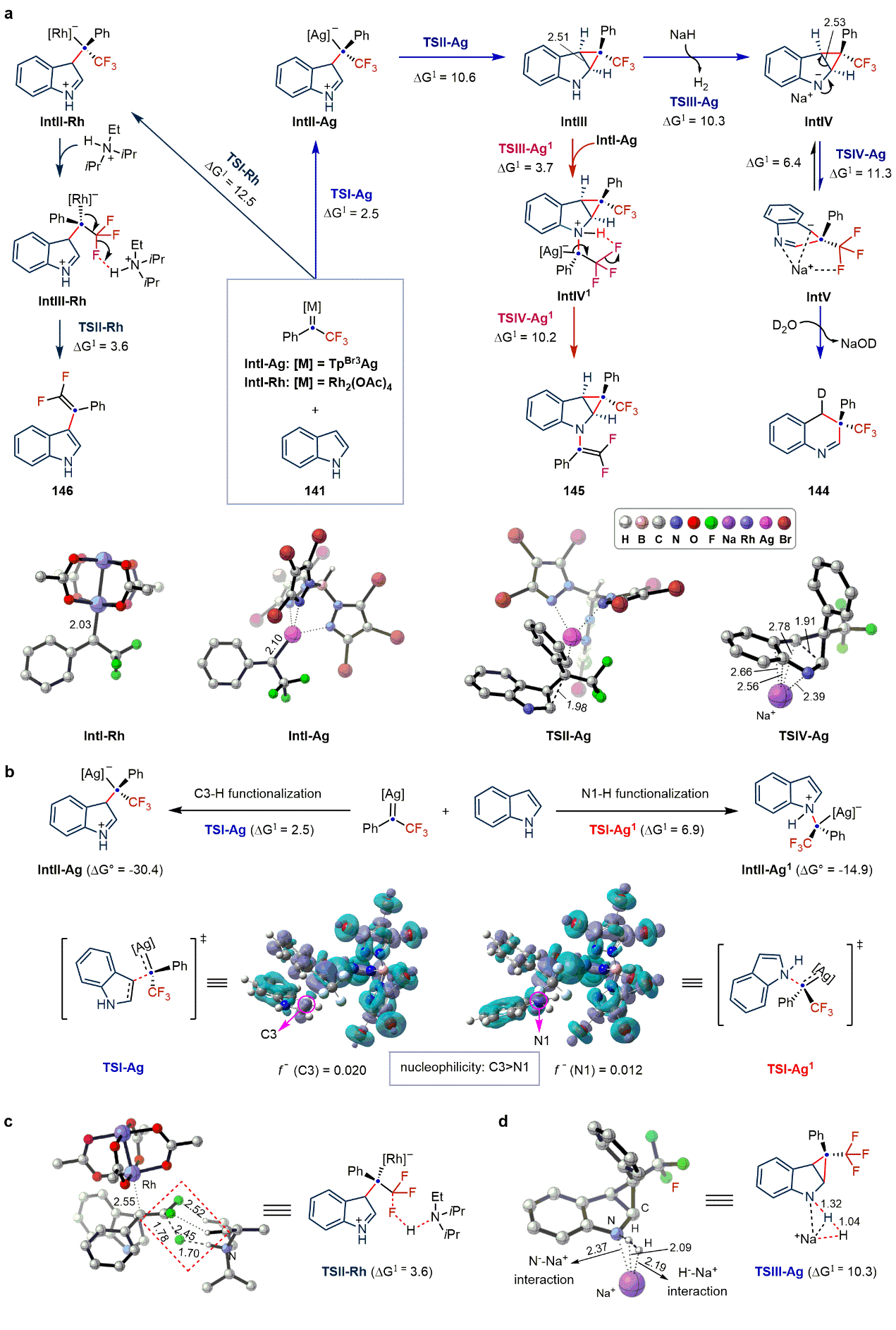
图5:反应机理研究(图片来源:Nat. Chem.)。
综上所述,东北师范大学毕锡和教授团队以N-邻三氟甲基苯磺酰腙作为氟烷基卡宾前体,在银或者铑催化下实现了对吲哚分子的可控分子编辑反应,反应具有高效、高选择性、高官能团容忍度等优点。此项工作,再次证明了N-邻三氟甲基苯磺酰腙作为卡宾前体的显著优越性(Acc. Chem. Res. 2022, 55, 1763)。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s41557-024-01468-2