|
|
|
|
|
中科大实现逻辑调控传感平台用于细胞凋亡原位实时监测 |
|
|
2021年7月26日,中国科技大学化学系李涛教授课题组在《德国应用化学》上发表了一篇题为“Logic-Gated Proximity Aptasensing for Cell-Surface Real-Time Monitoring Apoptosis“的新研究。
研究组设计的H+和K+协同响应的tb-G4可以实现对细胞微环境的特异性响应,作为潜在的工具可以对细胞表面的生理过程进行实时监测,从而为肿瘤微环境提供了一个独特的信号传输系统,对构建智能核酸框架纳米器件应用于肿瘤的免疫干预和治疗开辟了新的途径。
内源性信号分子的分泌参与了许多细胞过程,如细胞间交流、代谢和凋亡。在细胞微环境中对这些分子信号的实时监测,可以直接了解细胞的生理和病理过程。尤其是在细胞凋亡的早期阶段,通过释放ATP作为信号分子可以触发吞噬细胞对凋亡细胞的迅速清除。鉴于化疗是目前常见的诱导肿瘤细胞凋亡治疗癌症的方法,同时结合目前细胞凋亡检测中复杂且难以实现原位检测的问题,因此我们希望设计一款智能的策略,通过特异性地识别肿瘤微环境进而捕获释放的内源ATP对抗癌药物刺激的细胞凋亡进行实时检测,不仅可以作为细胞凋亡检测的工具,也可以对不同化疗药物对肿瘤细胞的凋亡效果进行评估,从而在肿瘤的诊断和治疗上具有一定的潜力。
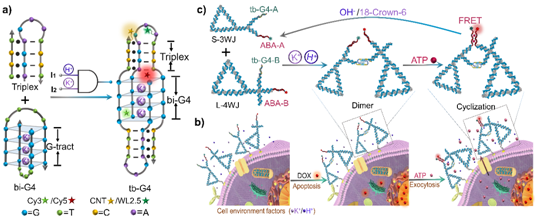
图1:协同反应的G-四链体诱导的邻近ATP 传感用于实时监测细胞凋亡的原理图。a) tb-G4s的设计:将传统loop替换为三链,实现对K+和H+的逻辑响应。b)细胞表面的核酸框架二聚纳米平台用于监测阿霉素诱导凋亡细胞释放的ATP。c) 细胞微环境响应的tb-G4操纵ATP逻辑传感工作原理。
在之前工作的基础上,课题组研究人员利用酸性响应的双分子i-motif结构实现了异源二聚的结合(Nucleic Acids Res. 2017, 45, 4306–4314; Angew. Chem. Int. Ed. 2019, 58, 1648–1653)。当在核酸框架上连接劈开的ATP适配体时,由于i-motif的邻近诱导作用,进而实现了对ATP靶分子的特异性检测。在该工作中,我们结合肿瘤微环境中富含的H+和K+,通过在双分子G-四链体的loop中嵌入pH响应的三链结构,设计了H+和K+响应的“AND”逻辑门双分子G-四链体结构(tb-G4),一方面提高了G-四链体本身的稳定性,另一方面实现了对肿瘤微环境的特异性响应。借助DNA 纳米三角形为核酸框架,通过在支点上连接带有tb-G4和劈开ATP适配体的三臂结构和四臂结构,当在pH5.0和K+同时存在下,实现了tb-G4的异源结合,进而搭建了邻近诱导的二聚平台促进ATP的特异性结合。
当用化疗药物对细胞进行凋亡刺激时,细胞表面会释放出内源的ATP。通过胆固醇修饰的DNA纳米三角形靶定在细胞膜表面,tb-G4对细胞微环境中的H+和K+进行逻辑响应,可以诱导DNA纳米平台对胞外不同的ATP水平进行特异性响应,进而对早期凋亡细胞实现原位实时监测。
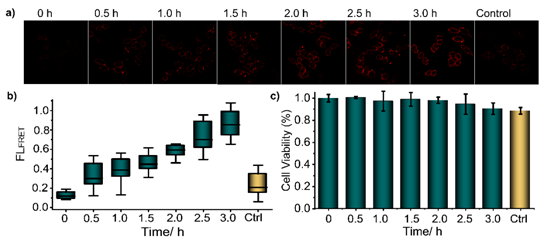
图2:邻近诱导的ATP传感器原位实时监测阿霉素刺激Hela细胞凋亡过程。(a)10 µM 阿霉素刺激后,一定时间间隔孵育(0-3 h)监测细胞释放ATP的共聚焦显微镜图像;对照系统孵养3 h。比例尺= 20 µM。(b) Image-J对(a)中对应荧光强度的量化分析。(c) 阿霉素刺激后不同时间孵育的细胞存活率分析。平均值±SD (n = 5)。
因此,我们设计的H+和K+协同响应的tb-G4可以实现对细胞微环境的特异性响应,作为潜在的工具可以对细胞表面的生理过程进行实时监测,从而为肿瘤微环境提供了一个独特的信号传输系统,对构建智能核酸框架纳米器件应用于肿瘤的免疫干预和治疗开辟了新的途径。(来源:科学网)
相关论文信息:https://doi.org/10.1002/anie.202106651