|
|
|
|
|
1,1-二烷基取代烯烃与未活化烷基亲电试剂的催化不对称氢烷基化反应 |
|
|
2026年1月13日,东北师范大学化学学院张前教授、熊涛教授团队在Nature Synthsis期刊上发表题为“Catalytic asymmetric hydroalkylation of 1,1-dialkyl-substituted alkenes with unactivated alkyl electrophiles”的研究论文。
该成果报道了钴氢化物催化的 1,1 - 二烷基取代烯烃与未活化烷基亲电试剂的不对称氢烷基化反应。该方法的对映选择性控制无需依赖现有方法中常用的杂原子或芳基官能团。为构建具有手性叔碳中心(其取代基的空间位阻与电子性质较为相似)的化合物提供了新途径。论文通讯作者为熊涛教授;第一作者为马树成博士、祝丽涵博士和尹建军博士。
C(sp3)- C(sp3)键是有机分子和聚合物中最常见的结构单元之一。研究表明,提升化合物中C(sp3)中心与手性中心的占比,有助于提高候选药物分子的临床研发成功率。利用金属催化的方式构建碳碳键是最直接和最有效的方法之一。使用烯烃和烷基亲电试剂为底物的催化不对称氢烷基化反应,在过去十年中虽然取得了显著进展,但仍需要在底物的特定位点预先引入杂原子官能团(如氧、氮、硼或氟原子)去精准实现立体化学控制和高反应效率。近期研究表明,通过手性配体与芳环之间的C-H-π相互作用,可以实现 1,1取代的芳基烯烃的不对称氢烷基化反应(Nat. Synth. 3, 1134–1144)。然而,烯烃中的芳基仍然是不可或缺的。相比之下,在不依赖此类辅助官能团的情况下,实现偕二烷基取代烯烃与烷基亲电试剂的不对称交叉偶联反应则更具挑战性。在此,张前教授/熊涛教授团队报道了一种钴氢化物催化的 1,1 - 二烷基取代烯烃与未活化烷基亲电试剂的不对称氢烷基化反应(图1)。该方法具有广泛的底物适用范围和优异的官能团兼容性。
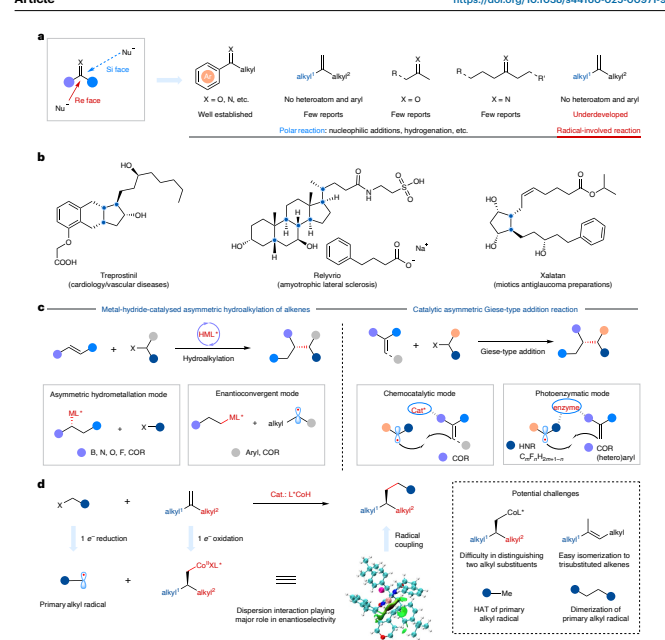
图1:金属催化的不对称烷基化反应。
该团队以 1,1-四氢- 2H-吡喃甲基取代的末端烯烃和一级烷基溴作为模型底物,对一系列配体双恶唑啉(BiOX)、膦恶唑啉(PHOX)、吡啶恶唑啉(PyOX)和双恶唑啉(BOX)进行筛选后,发现 BOX 型配体表现出优异的选择性和产率。其中配体 L14 表现出卓越的反应活性和立体化学控制能力,能够以86%产率和92%的e.e.值得到氢烷基化产物(图2)。
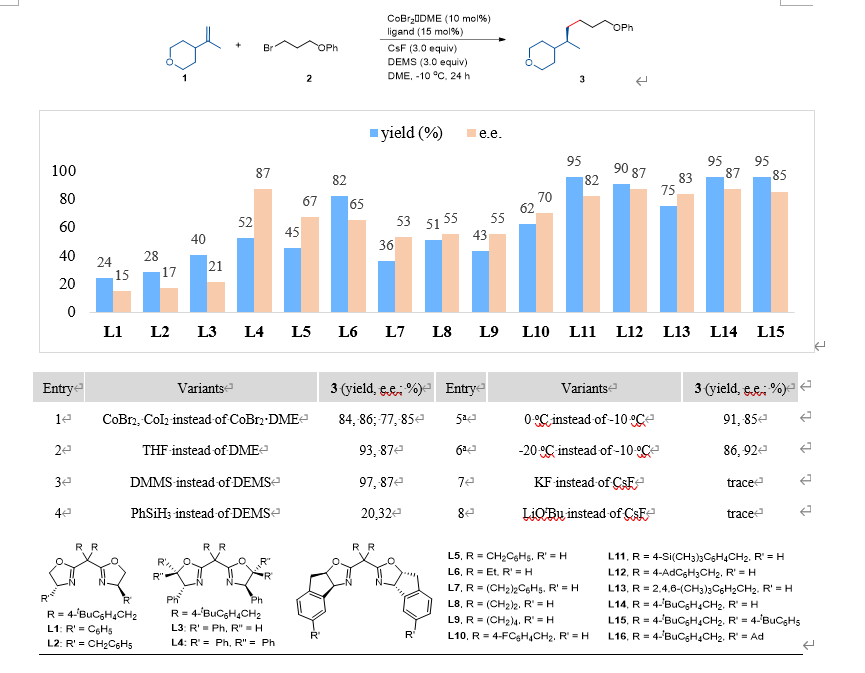
图2:反应的优化。
在最优条件下,该研究团队探究反应体系的烷基亲电试剂的适用范围。含有给电子基团(如甲氧基、硫甲基)或吸电子基团(如苯基、卤素、三氟甲氧基、三氟甲基)的芳氧基取代溴丙烷,敏感基团(如硅醚、酯基、磺酰酯基)均能够以良好的产率和优异的对映选择性得到目标产物。为排除底物氧原子配位作用的可能性,使用环烷烃取代烯烃,不含杂原子的一级烷基溴化物时也可以得到目标产物。该不对称氢烷基化反应还可应用于无环二级烷基取代烯烃(图3)。该方法还可以应用到天然产物、药物或其衍生物的高选择性后期功能化上,表明该方法具有潜在的广泛底物适用性。
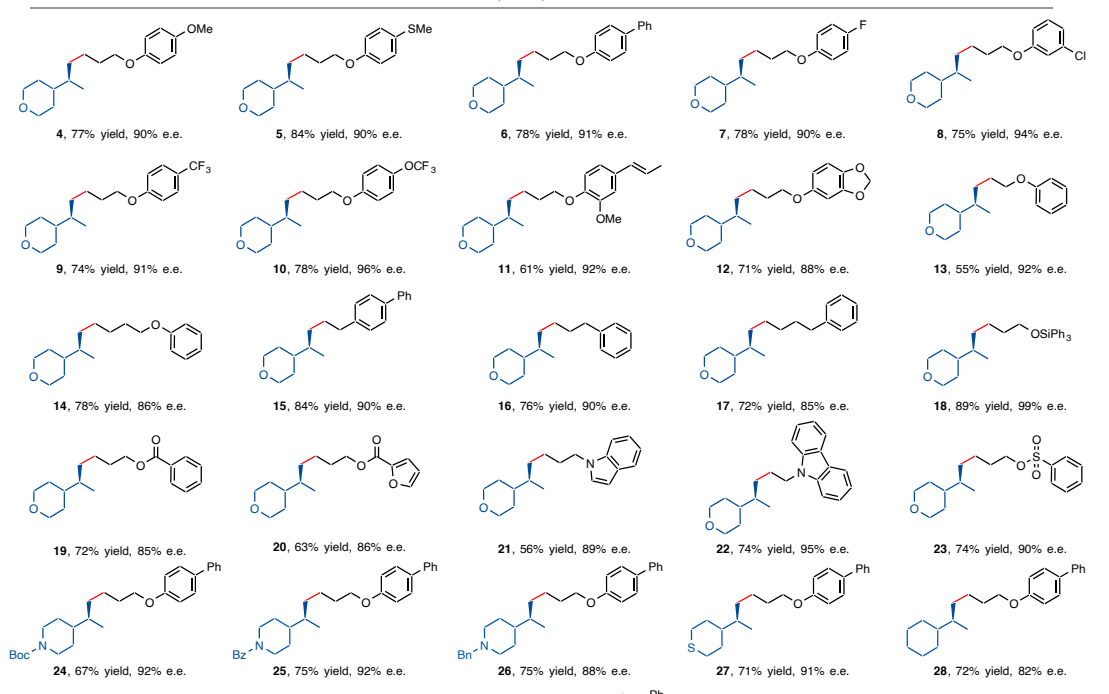
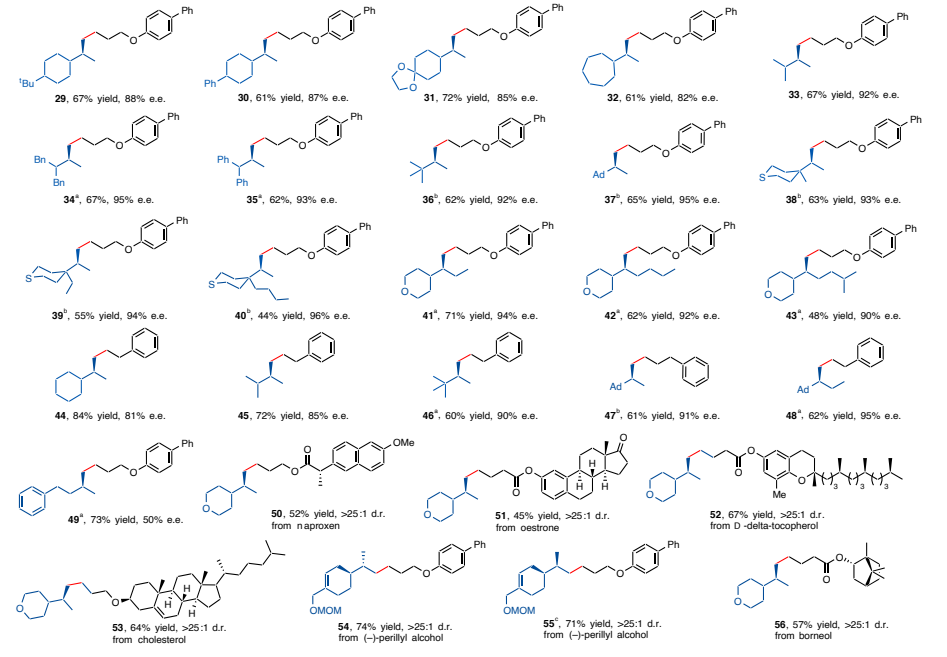
图3:底物拓展。
为深入了解反应路径,该团队开展了一系列实验以探究反应机理(图 4a)。首先进行了氘标记实验:在标准反应条件下,以 PhSiD3作为氘源,于 0℃反应,仅在产物(d-15)中甲基的 α 位检测到氘标记,未观察到氢/氘交换现象。这表明该反应可能通过钴氢中间体与碳-碳双键发生不可逆氢金属化的路径进行。通过自由基钟实验,验证了烷基溴化物的自由基反应路径。动力学实验表明,L*Co-H 物种的生成、烷基溴化物的氧化加成以及还原消除过程可能不涉及限速步骤,烯烃的氢金属化过程很可能是反应的限速步骤(图4)。
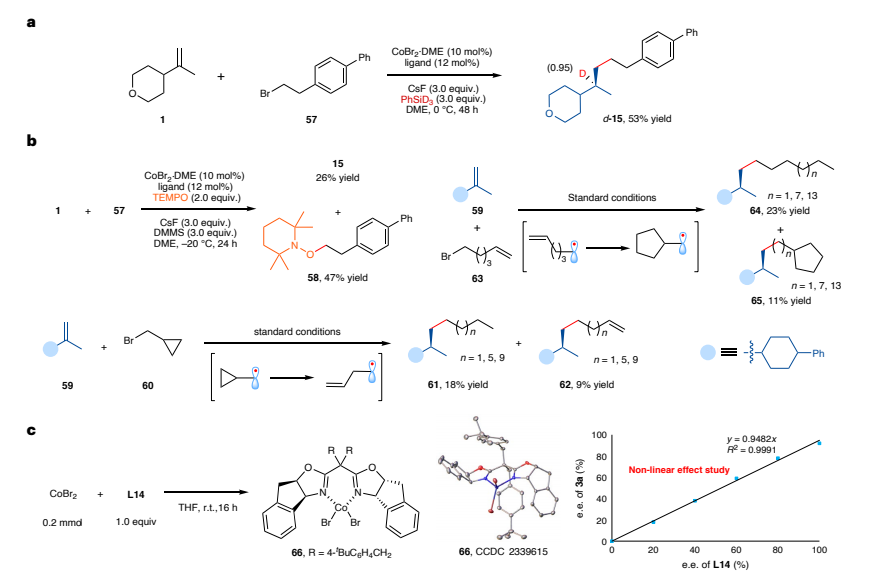
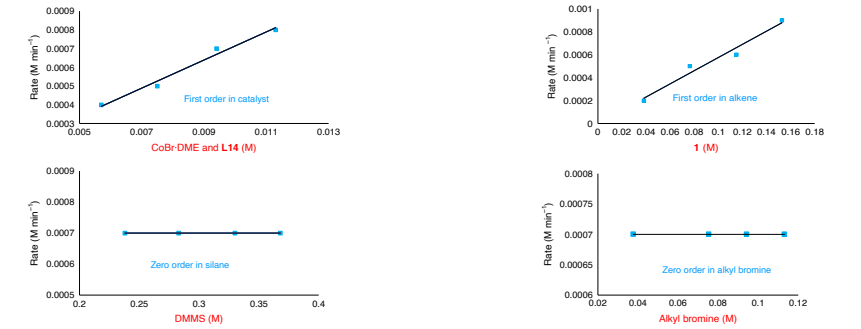
图4:机理研究。
基于上述实验结果和密度泛函理论(DFT)计算,该反应的机理(图5)为:在催化循环中,首先 Co(I)盐与烷基溴化物发生单电子转移(SET)过程,生成 Co(II)物种和烷基自由基中间体;随后,在硅烷和碱的存在下,通过金属转移过程生成 L*Co(II)HBr 物种。随后,1,1-二烷基取代烯烃发生区域选择性和对映选择性氢金属化。烷基自由基与 Co(II)Br - 烷基物种结合,顺利生成 Co(III)物种,还原消除得到目标产物。
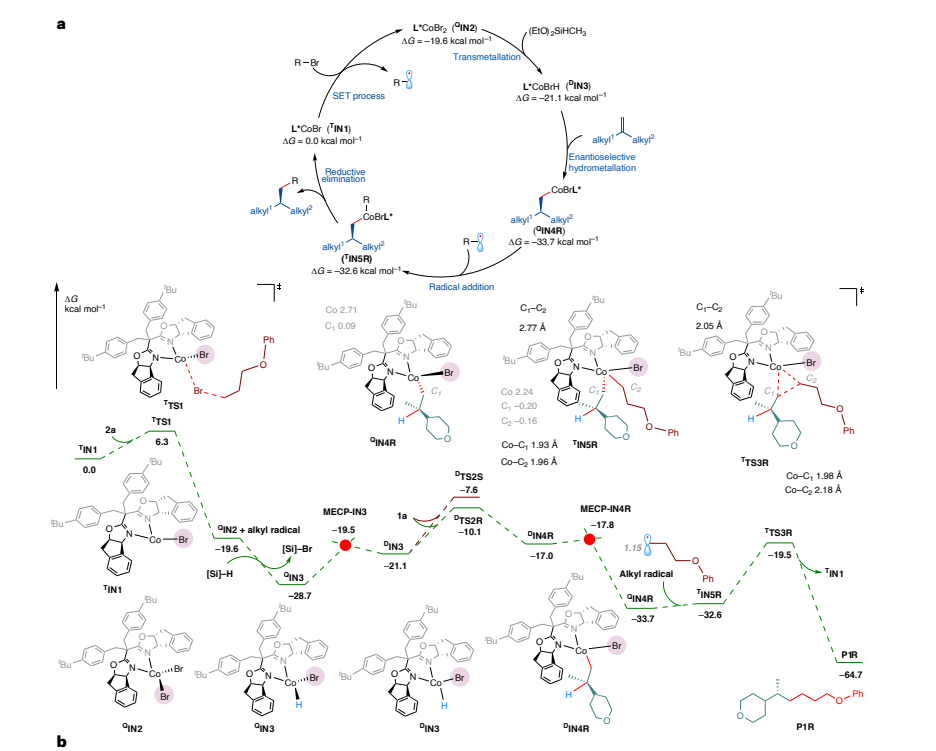
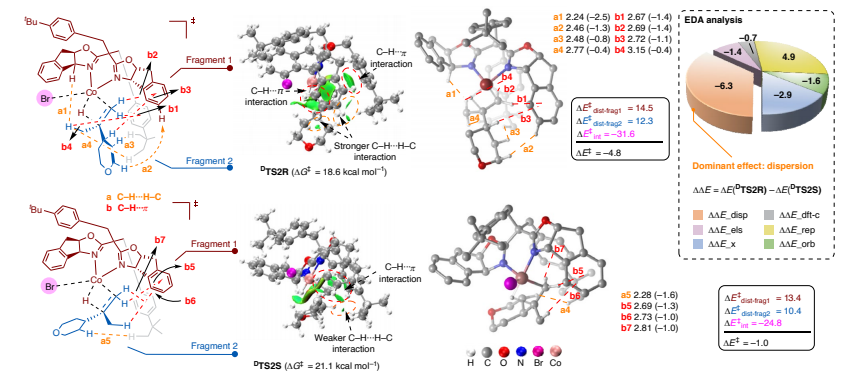
图5:提出机理。
综上所述,张前教授/熊涛教授团队报道了一种钴催化的不对称自由基氢烷基化反应:以未活化的烷基亲电试剂对1,1 -二烷基取代烯烃进行修饰,可构建 C (sp3)-C(sp3) 键。这种对映选择性控制无需依赖现有方法中常用的杂原子或芳基官能团辅助。机理研究表明,立体选择性主要源于催化剂与底物之间的色散作用,从而规避了底物特异性的限制。(来源:科学网)
相关论文信息:https://doi.org/10.1038/s44160-025-00971-9