非同源末端连接(non-homologous end joining,NHEJ)和同源重组(homologous recombination, HR)是细胞内主要的两种DNA双链断裂(DNA double strand break,DSB)修复途径。与HR相比,NHEJ不需要同源DNA作为修复模板,几乎可以在所有细胞周期发挥作用,且修复速度更加快速。细胞内约80%的DSBs由NHEJ修复。此外,一些细胞程序性的DNA断裂,如抗体基因形成过程中的VDJ 重排所产生的DSB,也由NHEJ修复。
NHEJ 修复途径可以大致划分为DNA末端识别、末端加工和连接三个步骤,由超过30种蛋白协同完成。其中,核心蛋白包括DNA-PKcs,Ku70, Ku80,XLF,XRCC4和LIG4。体外实验结果显示,核心蛋白可修复不需要加工的DNA粘性末端和平末端。然而,由离子辐射、紫外照射或其它因素导致的天然DSB往往伴随着碱基缺失、碱基损伤、末端加合等复杂后果,这些DNA末端经过多种加工酶处理后才能最终被LIG4连接。核酸酶Artemis,DNA聚合酶Pol μ、Pol λ、TDT 以及修复酶PNKP、TDP1等均被报道参与NHEJ,但目前并不清楚这些加工酶如何与NHEJ核心蛋白协同作用以应对复杂的DSB末端。
DNA聚合酶X家族蛋白Pol μ、Pol λ和TDT可以补齐DNA末端残留的缺口,为接下来的连接反应提供正确的DNA底物。此前已有报道,这些聚合酶的招募依赖于Ku70/80复合体(KU)和LIG4/XRCC4(L4X4),然而其具体的招募机制未知。此外,人们也不清楚这些聚合酶的功能是否受核心蛋白的调控。
2025年6月11日,来自美国国立卫生研究院(NIH)的杨薇和Martin Gellert研究团队在《自然》(Nature)在线发表了题为Dynamic assemblies and coordinated reactions of non-homologous end joining的研究论文。该论文在体外组装了含Pol μ的gap- filling复合物以及不含Pol μ的ligation复合物,并得到了3 Å左右的冷冻电镜高分辨率结构模型,阐明了NHEJ途径最后两步中DNA修复机器的组装及动态变化,并揭示了DNA聚合酶和连接酶的协同反应机制。
首先,研究团队纯化了所有NHEJ核心蛋白、Pol μ以及附属蛋白PAXX,并在体外重构NHEJ途径中gap-filling和ligation反应。酶活实验表明KU能极大促进L4X4的连接效率,进一步加入XLF或同时加入XLF和 PAXX可以更加提高产物生成;而DNA-PKcs极大的抑制连接反应。因此,研究人员确定KU、L4X4、XLF、PAXX可以在DNA底物上形成具有活性的ligation复合物。另外,他们发现 KU+L4X4+XLF+PAXX可以最大限度地促进Pol μ gap-filling的功能,因此KU、L4X4、XLF、PAXX、Pol μ参与形成gap-filling复合物。
然后,研究人员利用单颗粒冷冻电镜技术解析了gap-filling和ligation复合物结构。由于样品柔性大且某些区域相互作用弱,在不使用交联剂情况下,很难获得完整复合物,而Grafix可以有效的将完整复合物交联起来。通过对交联剂浓度的优化,研究人员成功得到均一的复合物样品并将其分辨率推到3.1 Å。此前已有一个由KU-L4X4-XLF-DNA组成的ligation复合物结构被报道 2,但其整体分辨率只有8.9 Å,本文所获得的结构模型在准确度上取得了巨大进步,能提供更加丰富的结构信息。
(1) 两种复合物具有相似的结构框架。两个KU分别结合在两段DNA上,XRCC4-XLF-XRCC4形成ω型框架,并通过LIG4 BRCT结构域结合在两个KU上,因此两段DNA被固定在同一个复合物中(图1)。这种结构框架的弹性支持gap-filling和ligation之间的构象转变。
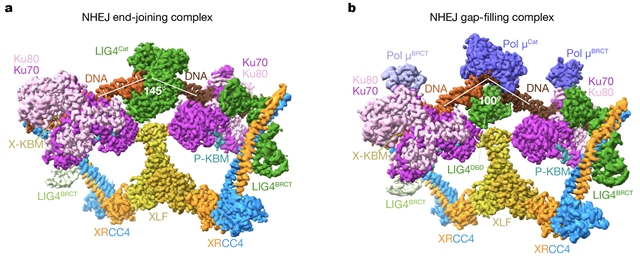
图1 NHEJ ligation (a) 和gap-filling (b) 复合物电镜结构。
(2)Pol μ的招募依赖于其BRCT结构域与KU bridge的相互作用。gap-filling复合物可结合两个Pol μ,其中只有一个Pol μ的酶活结构域结合在DNA gap上,另一个Pol μ的酶活结构域由于没有DNA底物分子结合而游离在外,因此在电镜密度图上不可见。由于BRCT结构域在Pol μ、Pol λ和TDT中保守,因此这类聚合酶应该是以相同的方式参与到NHEJ途径中。
(3)gap-filling和ligation的协同反应机制。在ligation复合体中,LIG4结合在DNA末端,精细的三维分类使之清晰观察到了LIG4将ATP从赖氨酸转移至DNA末端的两个关键酶活步骤。有趣的是,在gap-filling复合物中,虽然Pol μ占据了DNA末端的位置,但LIG4并没有离开,而是转变为open构象,只有LIG4 NTD让出DNA结合位点给Pol μ,而LIG4 DBD对DNA的结合几乎保持不变(图2)。结构分析表明,LIG4 DBD始终结合两段DNA防止其解离,为其它末端加工酶的结合提供条件;其次,LIG4 NTD始终保持在修复位点附近,一旦DNA末端具备连接条件,NTD可迅速结合到DNA末端对其进行连接。LIG4的这种作用机制保证gap-filling和ligation能协同反应,对NHEJ修复效率具有重要意义。
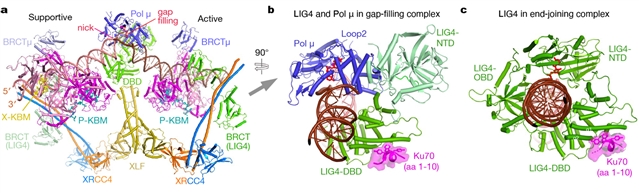
图2 LIG4酶活结构域在gap-filling复合物 (a, b) 和ligation复合物 (c)中的结构对比。
(4)本文对XLF和PAXX的功能提供了结构层面的见解。PAXX与XLF有相似结构,之前的研究表明其与XLF之间有一定的功能冗余,但XLF的功能更不可或缺。在解析的两个复合物结构中,我们同时观察到了PAXX和XLF。XLF X-KBM结合两个Ku80,而PAXX P-KBM结合两个Ku70,它们以相似的方式将结合在两段DNA上的KU拉近,从而有机会形成稳定的gap-filling或ligation复合物。然而,XLF与其它蛋白存在多重相互作用,在稳定复合物结构方面起核心作用。相反,PAXX head结构域与其它蛋白不存在特异相互作用,功能实验显示PAXX head可被其它可形成二体的结构域替代。这些信息解释了为什么在NHEJ通路中XLF比PAXX的作用更为核心。
总之,本文通过高分辨率的结构信息,详细解析了NHEJ途径中gap-filling和ligation过程中DNA修复机器的组装和动态工作机制,加深了人们对NHEJ这一重要的DNA修复途径的认识,并为相关的制药及基因治疗研究提供精准的靶标模型。
Martin Gellert课题组的博士后刘兰和杨薇课题组博士后李军为本文的共同第一作者。来自Beckman Research Institute of the City of Hope的Metztli Cisneros-Aguirre, Arianna Merkell 和Jeremy M. Stark也为本文研究做出重要贡献。(来源:科学网)
相关论文信息:https://www.nature.com/articles/s41586-025-09078-9